
| A. | PH=7,溶液一定显中性 | |
| B. | 当溶液c(H+)=c(OH-)时,溶液显中性 | |
| C. | 正盐溶液一定显中性,酸性盐溶液可能显酸性或碱性 | |
| D. | 当溶液显酸性时,水电离的c(H+)>c(OH-) |
分析 溶液的酸碱性取决于溶液中c(OH-)、c(H+)的相对大小,如果c(OH-)>c(H+),溶液呈碱性,如果c(OH-)=c(H+),溶液呈中性,如果c(OH-)<c(H+),溶液呈酸性.
解答 解:A、pH=7的溶液不一定呈中性,如100℃时,纯水的pH<7,则该温度下,pH=7的溶液呈碱性,故A错误;
B、溶液中如果c(OH-)=c(H+),则溶液呈中性,故B正确;
C、正盐溶液不一定显中性,若为强碱弱酸的正盐溶液,则显碱性,若为强酸弱碱的正盐溶液,则显酸性,故C错误;
D、水电离出的c(H+)和c(OH-)永远相等,故D错误.
故选B.
点评 本题考查溶液酸碱性的判断,明确溶液的酸碱性取决于溶液中c(OH-)、c(H+)的相对大小是解本题关键,易错选项是D,注意不能单纯根据pH判断溶液的酸碱性,为易错点.


科目:高中化学 来源: 题型:选择题
 咖啡酸(如图),存在于许多中药,如野胡萝卜、光叶水苏、荞麦等中.咖啡酸有止血作用.下列 关于咖啡酸的说法不正确的是( )
咖啡酸(如图),存在于许多中药,如野胡萝卜、光叶水苏、荞麦等中.咖啡酸有止血作用.下列 关于咖啡酸的说法不正确的是( )| A. | 咖啡酸的分子式为C9H8O4 | |
| B. | 1 mol咖啡酸可以和含4 molBr2的浓溴水反应 | |
| C. | 1 mol咖啡酸与足量NaHCO3溶液反应能产生标况下约67.2L的CO2 | |
| D. | 不可以用高锰酸钾检验咖啡酸分子中的碳碳双键 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加入有色布条,一会儿有色布条褪色,说明溶液中有Cl2存在 | |
| B. | 新制氯水可使蓝色石蕊试纸先变红后褪色 | |
| C. | 氯气长时间放置后酸性减弱 | |
| D. | 加入NaOH溶液,氯水黄绿色消失,说明有HClO分子存在 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0~1min,CO的平均反应速率为o.5mol/(L•min) | |
| B. | 增大压强,化学反应速率加快,K增大 | |
| C. | H2S的平衡转化率为71.4% | |
| D. | 平衡后,又加入CO、H2各1mol,平衡逆动 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
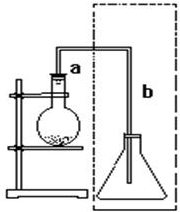 如图是实验室制取溴苯的装置,说明:
如图是实验室制取溴苯的装置,说明:查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 密度(g/cm3) | 熔点(℃) | 沸点(℃) | 溶解性 | |
| 环己醇 | 0.96 | 25 | 161 | 能溶于水 |
| 环己烯 | 0.81 | -103 | 83 | 难溶于水 |
 、SO2、CO2及水蒸气,混合气体通过试剂的顺序是
、SO2、CO2及水蒸气,混合气体通过试剂的顺序是
查看答案和解析>>
科目:高中化学 来源: 题型:解答题


 CH3COOCH2CH3+H2O,用饱和的碳酸钠溶液(填药品名称)收集粗产品,用分液(填操作名称)的方法把粗产品分离.
CH3COOCH2CH3+H2O,用饱和的碳酸钠溶液(填药品名称)收集粗产品,用分液(填操作名称)的方法把粗产品分离.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com