
| A. | +184.6kJ•mol-1 | B. | -92.3kJ•mol-1 | C. | -69.2kJ•mol-1 | D. | +92.3kJ•mol-1 |
分析 热化学方程式是表示化学反应与反应热关系的方程式,书写和应用热化学方程式时必须注意:反应热与反应方程式相互对应.若反应式的书写形式不同,则相应的化学计量系数不同,故反应热亦不同;反应方向改变,焓变数值符号改变.
解答 解:依据热化学方程式 的书写原则和方法,已知热化学方程式为:H2(g)+Cl2(g)=2HCl(g)△H=-184.6kJ•mol-1,
改变方向,焓变变为正值,系数除以2,焓变也除以2,得到热化学方程式为:HCl(g)=$\frac{1}{2}$H2(g)+$\frac{1}{2}$Cl2(g)△H=+92.3kJ•mol-1,
故选D.
点评 本题考查了热化学方程式的书写方法和注意问题,熟练掌握书写原则是解题关键,题目较简单.


科目:高中化学 来源: 题型:选择题
| A. | 1 mol Na2O2晶体中含有的阴离子数目为2NA | |
| B. | 1 mol Na2O2与足量CO2反应时,转移2NA个电子 | |
| C. | 1 mol•L-1的NaOH溶液中含Na+数目为NA | |
| D. | 1 mol钠与足量氧气反应生成Na2O或Na2O2时,失电子数目均为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
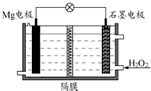 Mg-H2O2电池可用于驱动无人驾驶的潜航器.该电池以海水为电解质溶液(加入一定量酸),示意图如图.该电池工作时,下列说法正确的是( )
Mg-H2O2电池可用于驱动无人驾驶的潜航器.该电池以海水为电解质溶液(加入一定量酸),示意图如图.该电池工作时,下列说法正确的是( )| A. | 电池工作时,石墨周围海水的pH减少 | |
| B. | 电池工作时,溶液中的H+向负极移动 | |
| C. | 电池总反应为Mg+H2O2+2H+═Mg2++2H2O | |
| D. | Mg电极是该电池的正极 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 某化学研究性学习小组探究Fe3+和SO32-之间发生的反应.
某化学研究性学习小组探究Fe3+和SO32-之间发生的反应.| 操作 | 现象及结论 |
| 基于方案一: | |
| 基于方案二: |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
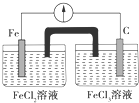
| A. | Fe是负极,C是正极 | B. | 负极反应式:Fe-3e-═Fe3+ | ||
| C. | 内电路中阴离子移向FeCl2溶液 | D. | 电流由石墨电极流向Fe电极 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1.5mol | B. | 2mol | C. | 2.5mol | D. | 4mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②④ | B. | ②③④ | C. | ①③④⑤ | D. | ①②③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H+、Na+、NO3-、MnO4- | B. | OH-、Ba2+、Cl-、SO42- | ||
| C. | HCO3-、K+、OH-、NO3- | D. | NO3-、SO42-、K+、Mg2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
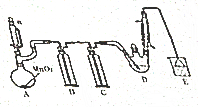 某探究小组设计如图所示装置(夹持、加热仪器略)、模拟工业生产进行制备氯乙醛(CCl3CHO)的实验,查阅资料,有关信息如图所示:
某探究小组设计如图所示装置(夹持、加热仪器略)、模拟工业生产进行制备氯乙醛(CCl3CHO)的实验,查阅资料,有关信息如图所示:| C2H5OH | CCl3CHO | CCl3COOH | C2H5Cl | |
| 熔点/℃ | -114.1 | -57.5 | 58 | -138.7 |
| 沸点/℃ | 78.3 | 97.8 | 198 | 12.3 |
| 溶解性 | 与水互溶 | 可溶于水、乙醇 | 可溶于水、乙醇 | 微溶于水、可溶于乙醇 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com