
| A. | 苯酚有一定毒性,不能用作消毒剂和防腐剂 | |
| B. | 制作航天服的聚酯纤维和用于光缆通信的光导纤维都是新型无机非金属材料 | |
| C. | 乙醇和乙酸都是常用调味品的主要成分 | |
| D. | 油脂是人体需要的重要的营养成分,属于天然高分子化合物 |
分析 A、苯酚有一定的毒性,也能用于杀菌消毒;
B、聚酯纤维是有机物;
C、料酒的主要成分为乙醇,醋的主要成分为乙酸;
D、高分子化合物是指相对分子质量大于1万的有机物.
解答 解:A、苯酚有一定的毒性,也能用于杀菌消毒,也有防腐的功能,故A错误;
B、聚酯纤维是有机物,不是无机非金属材料,而光导纤维的主要成分为二氧化硅,是无机非金属材料,故B错误;
C、乙醇为料酒的主要成分,乙酸为食醋的主要成分,故均为常用的调味品的主要成分,故C正确;
D、高分子化合物是指相对分子质量大于1万的有机物,而油脂不是高分子化合物,故D错误.
故选C.
点评 本题考查了化学物质在生活中的应用,难度不大,应注意的是高分子化合物的界定.


科目:高中化学 来源: 题型:填空题
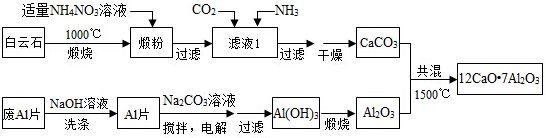
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
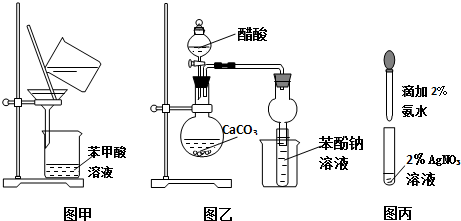
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
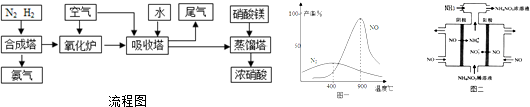
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH3CH2CH2CH3 | B. | CH3CH(CH3)2 | C. | (CH3)2CHCH2CH3 | D. | CH3C(CH3)3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向AlCl3溶液中滴加浓氨水至过量:Al3++4OH-=AlO2-+2H2O | |
| B. | 向NaOH溶液中通入少量的CO2:OH-+CO2=HCO3- | |
| C. | 向Ca(HCO3)2溶液中加入过量NaOH溶液:Ca2++HCO3-+OH-═CaCO3↓+H2O | |
| D. | NaHSO4溶液与Ba(OH)2溶液反应至中性:2H++SO42-+Ba2++2OH-=BaSO4↓+2H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com