(2013?淄博二模)海水是丰富的资源宝库,从海水中提取元素是化学工业的重要组成部分.
(1)粗盐精制就是除去其中的Ca
2+、Fe
3+、SO
42-及泥沙等杂质,需加入的试剂有:
①Na
2CO
3溶液
②HCl(盐酸)
③Ba(OH)
2溶液,这三种试剂的添加顺序是
③①②
③①②
(填序号).
(2)用氯气进行“海水提溴”中制取溴单质反应的离子方程式为:
Cl2+2Br-=2Cl-+Br2
Cl2+2Br-=2Cl-+Br2
.
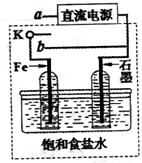
(3)某同学设计了如图装置进行以下电化学实验.
①当开关K与a连接时,两极均有气泡产生,则阴极为
Fe(或铁)
Fe(或铁)
极.
②一段时间后,使开关K与a断开、与b连接时,虚线框内的装置可称为
原电池
原电池
.请写出此时Fe电极上的电极反应式
Fe-2e-+2OH-=Fe(OH)2↓
Fe-2e-+2OH-=Fe(OH)2↓
.
(4)某公厂向盛有CaSO
4悬浊液的反应池中通入氨气欲制取氮肥(NH
4)
2SO
4,效果不好.再通入CO
2,则逐渐产生大量(NH
4)
2SO
4.请分析其原因
[已知常温下:Ksp(CaSO4)=3.2×10-5,Ksp(CaCO3)=2.8×10-9].

 (2013?淄博二模)海水是丰富的资源宝库,从海水中提取元素是化学工业的重要组成部分.
(2013?淄博二模)海水是丰富的资源宝库,从海水中提取元素是化学工业的重要组成部分.
