
下列离子方程式不正确的是 ( )。
A.石英与烧碱反应:SiO2+2OH-===SiO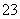 +H2O
+H2O
B.硅与烧碱反应:Si+2OH-===SiO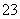 +H2↑
+H2↑
C.硅酸钠溶液中通入少量CO2:SiO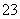 +CO2+H2O===CO
+CO2+H2O===CO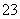 +H2SiO3↓
+H2SiO3↓
D.往水玻璃中加入盐酸:2H++SiO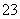 ===H2SiO3↓
===H2SiO3↓
科目:高中化学 来源: 题型:
溴化碘(IBr)的化学性质与卤素单质相似,能与大多数金属反应生成金属卤化物,和某些非金属单质反应生成相应的卤化物,跟水反应的方程式为IBr+H2O===HBr+HIO,下列有关IBr的叙述中,不正确的是 ( )。
A.IBr是双原子分子
B.在很多反应中,IBr是强氧化剂
C.和NaOH溶液反应生成NaBr和NaIO
D.和水反应时,既是氧化剂又是还原剂
查看答案和解析>>
科目:高中化学 来源: 题型:
某同学向一支试管中按一定的顺序分别加入下列几种物质(一种物质只加一次):
a.KI溶液;b.淀粉溶液;c.NaOH溶液;d.稀H2SO4;e.氯水。发现溶液颜色按如下顺序变化:①无色→②棕黄色→③蓝色→④无色→⑤蓝色,对此过程进行的分析中错误的是 ( )。
A.加入以上药品的顺序是a→e→b→c→d
B.③→④反应的化学方程式为I2+2NaOH===NaI+NaIO3+H2O
C.溶液由棕黄色变为蓝色的原因是淀粉溶液遇碘变蓝色
D.④→⑤反应的离子方程式为2I-+Cl2===I2+2Cl-
查看答案和解析>>
科目:高中化学 来源: 题型:
关于硅及其化合物的叙述中,错误的是 ( )。
A.硅是良好的半导体材料
B.二氧化硅能与石灰石反应:SiO2+CaCO3 CaSiO3+CO2↑
CaSiO3+CO2↑
C.可以用焦炭还原二氧化硅生产硅:SiO2+2C Si+2CO↑
Si+2CO↑
D.水泥的主要成分是Na2SiO3、CaSiO3和SiO2
查看答案和解析>>
科目:高中化学 来源: 题型:
硅及其化合物对人类现代文明具有特殊贡献。请回答下列有关问题:
(1)硅原子的结构示意图为:________。
(2)下列物品或设备所用材料属于硅酸盐的是____________________________ _______________________________________。
①长江三峡水泥大坝 ②光导纤维 ③陶瓷坩埚
④普通玻璃 ⑤硅太阳能电池
A.①②③ B.③④⑤
C.②③④ D.①③④
(3)下列说法正确的是________。
A.在粗硅的制取中发生2C+SiO2 2CO↑+Si,硅被还原,所以碳的还原性大于硅的还原性
2CO↑+Si,硅被还原,所以碳的还原性大于硅的还原性
B.硅酸钠属于盐,不属于碱,所以硅酸钠可以保存在磨口玻璃塞试剂瓶中
C.用SiO2制取硅酸,应先使二氧化硅与氢氧化钠溶液反应,然后再通入CO2
D.由Na2CO3+SiO2 CO2↑+Na2SiO3可知硅酸的酸性大于碳酸
CO2↑+Na2SiO3可知硅酸的酸性大于碳酸
(4)常温下,SiCl4为液态,沸点为57.6 ℃,在空气中冒白雾。制备高纯度硅的中间产物SiCl4中溶有液态杂质,若要得到高纯度SiCl4,应采用的方法是____________;用化学方程式及必要的文字解释SiCl4在空气中冒白雾的原因:______________________________________________________________
_______________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列图像能表示相关反应中生成物物质的量的变化的是(横、纵坐标单位:mol) ( )。
A.图1:n(HCl)=1 mol,K2CO3加入到HCl溶液中,在敞口容器中生成的气体
B.图2:n(NaOH)=1 mol,CO2通入到NaOH溶液中反应生成的盐
C.图3:n(O2)=1 mol,高温下C和O2在密闭容器中的生成物
D.图4:n(HNO3)=1 mol,Fe和稀HNO3反应生成的氧化产物(还原产物为NO)
查看答案和解析>>
科目:高中化学 来源: 题型:
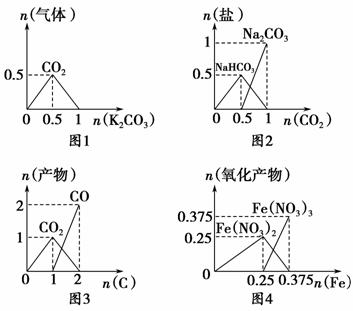
部分氧化的FeCu合金样品(氧化产物为Fe2O3、CuO)共5.76 g,经如下处理:
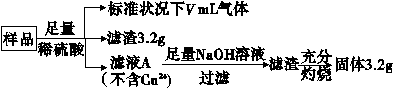
下列说法正确的是 ( )。
A.滤液A中的阳离子为Fe2+、Fe3+、H+
B.样品中Fe元素的质量为2.24 g
C.样品中CuO的质量为4.0 g
D.V=896 mL
查看答案和解析>>
科目:高中化学 来源: 题型:
有一含NaCl、Na2CO3·10H2O和NaHCO3的混合物,某同学设计如图所示的实验装置,通过测量反应产生的CO2和H2O的质量,来确定该混合物中各组分的质量分数。
(1)实验步骤:
①按图(夹持仪器未画出)组装好实验装置后,首先进行的操作是____________________。
②称取样品,并将其放入硬质玻璃管中;称量装浓硫酸的洗气瓶C的质量和装碱石灰的U形管D的质量。
③打开活塞K1、K2,关闭K3,缓缓鼓入空气数分钟,其目的是______________________。
④关闭活塞K1、K2,打开K3,点燃酒精灯加热至不再产生气体。装置B中发生反应的化学方程式为________________________________________
____________________________________________________、
___________________________________________________。
⑤打开活塞K1,缓缓鼓入空气数分钟,然后拆下装置,再次称量洗气瓶C的质量和U形管D的质量。
(2)关于该实验方案,请回答下列问题。
①若加热反应后不鼓入空气,对测定结果的影响是______________________ _______________________________________________________。
②E处干燥管中盛放的药品是________,其作用是___________________,如果实验中没有该装置,则会导致测量结果NaHCO3的质量分数________(填“偏大”、“偏小”或“无影响”)。
③若样品质量为w g,反应后C、D装置增加的质量分别为m1 g、m2 g,则混合物中Na2CO3·10H2O的质量分数为________(用含w、m1、m2的代数式表示)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com