
【题目】已知乙醛(CH3CHO)和新制氢氧化铜的反应如下:
CH3CHO+2Cu(OH)2+NaOH![]() CH3COONa+Cu2O↓+3H2O
CH3COONa+Cu2O↓+3H2O
某实验小组做上述反应时,发现NaOH的用量对反应产物有影响,于是他们采用控制变量的方法,均使用0.5 mL 40%的乙醛溶液进行下列实验。
编号 | 2%CuSO4溶液的体积 | 10%NaOH溶液的体积 | 振荡后 的现象 | pH | 加乙醛水浴加热后的沉淀颜色 |
1 | 2 mL | 3滴 | 浅蓝绿色沉淀 | 5~6 | 浅蓝绿色沉淀 |
2 | a | 15滴 | 浅蓝色沉淀 | 7~8 | 黑色沉淀 |
3 | 1 mL | 1 mL | 蓝色悬浊沉淀较少 | 9~10 | 红褐色沉淀 |
4 | b | 2 mL | 蓝色悬浊沉淀较多 | 11~12 | 红色沉淀 |
5 | 1 mL | 3 mL | 蓝紫色溶液 | 12~13 | ———— |
(1)上表中a、b应为 (填字母序号)。
A.15滴,1 mL B.2 mL,1 mL C.15滴,2 mL D.2 mL,2 mL
(2)查阅资料可知,实验1中的浅蓝绿色沉淀主要成份为Cu2(OH)2SO4,受热不易分解。写出生成Cu2(OH)2SO4反应的化学方程式 。基于实验1、2的现象可以得出结论:NaOH用量较少时, 。
(3)小组同学推测实验3中的红褐色沉淀可能是CuO和Cu2O的混合物,其理论依据是 。
(4)为了进一步证明实验4中红色沉淀的成分,该小组同学查阅资料得知:Cu2O在碱性条件下稳定,在酸性溶液中可转化为Cu2+、Cu。并进行了以下实验。
ⅰ.将实验4反应后的试管静置,用胶头滴管吸出上层清液。
ⅱ.向下层浊液中加入过量稀硫酸,充分振荡、加热,应观察到的现象是 。
(5)小组同学继续查阅资料得知:Cu(OH)2可与OH-继续反应生成蓝紫色溶液([Cu(OH)4] 2-),由此提出问题:[Cu(OH)4] 2-能否与乙醛发生反应,生成红色沉淀?设计实验解决这一问题,合理的实验步骤是 。基于上述实验,该小组同学获得结论:乙醛参与反应生成红色沉淀时,需控制体系的pH>10。
【答案】(1)B
(2)2NaOH+2CuSO4=Cu2(OH)2SO4↓+Na2SO4
乙醛未参与氧化反应,(或是含铜元素的化合物在发生变化)
(3)当NaOH用量逐渐增多时,产生的Cu(OH)2一部分受热分解生成黑色的CuO;另一部分被乙醛还原为Cu2O红色沉淀,所以实验3中的红褐色沉淀,可能是CuO和Cu2O的混合物。
(4)溶液变为蓝色,有红色固体
(5)将1 mL 2%CuSO4溶液与3 mL(或>3 mL)10%NaOH溶液混合振荡后(或取实验5的蓝紫色溶液),加入0.5 mL 40%的乙醛溶液,水浴加热
【解析】
试题分析:(1)为控制变量,中a、b应为2 mL,1 mL;(2)生成Cu2(OH)2SO4反应的化学方程式2NaOH + 2CuSO4=Cu2(OH)2SO4↓+Na2SO4。基于实验1、2的现象可以得出结论:NaOH用量较少时,含铜元素的化合物在发生变化;(3)当NaOH用量逐渐增多时,产生的Cu(OH)2一部分受热分解生成黑色的CuO;另一部分被乙醛还原为Cu2O红色沉淀,所以实验3中的红褐色沉淀,可能是CuO和Cu2O的混合物;(4)Cu2O在碱性条件下稳定,在酸性溶液中可转化为Cu2+、Cu,向下层浊液中加入过量稀硫酸,充分振荡、加热,应观察到的现象是溶液变为蓝色,有红色固体;(5) [Cu(OH)4] 2-能否与乙醛发生反应,生成红色沉淀?实验解决这一问题,合理的实验步骤是,将1 mL 2%CuSO4溶液与3 mL(或>3 mL)10%NaOH溶液混合振荡后(或取实验5的蓝紫色溶液),加入0.5 mL 40%的乙醛溶液,水浴加热。基于上述实验,该小组同学获得结论:乙醛参与反应生成红色沉淀时,需控制体系的pH>10。


科目:高中化学 来源: 题型:
【题目】标准状况下V L氨气溶解在1L水中(水的密度近似为1g/mL),所得溶液的密度为ρ g/mL,质量分数为ω,物质的量浓度为c mol/L,则下列关系中正确的是( )
①ρ=(17V+22400)/(22.4+22.4V)
②ω=17c/(1000ρ)
③C=1000ρω/35
④ω=17V/(17V+22400)
⑤c=1000Vρ/(17V+22400)
A.①②④ ⑤ B.②④ ⑤ C. ③④ ⑤ D. ①② ⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)对于Ag2S(s)![]() 2Ag+(aq)+S2-(aq),其Ksp的表达式为________。
2Ag+(aq)+S2-(aq),其Ksp的表达式为________。
(2)下列说法不正确的是______________(填序号)。
①用稀盐酸洗涤AgCl沉淀比用水洗涤损耗AgCl少
②一般地,物质的溶解度随温度的升高而增加,故物质的溶解大多是吸热的
③对于Al(OH)3(s) ![]() Al(OH)3(aq)
Al(OH)3(aq) ![]() Al3++3OH-,前者为溶解平衡,后者为电离平衡
Al3++3OH-,前者为溶解平衡,后者为电离平衡
④除去溶液中的Mg2+,用OH-沉淀比用CO![]() 好,说明Mg(OH)2的溶解度比MgCO3的大
好,说明Mg(OH)2的溶解度比MgCO3的大
⑤沉淀反应中常加过量的沉淀剂,其目的是使沉淀更完全
(3)如何除去Mg(OH)2中混有的Ca(OH)2?
___________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向 0.1 mol/L 醋酸溶液中加水稀释,下列变化叙述错误的是( )
A. 溶液的 pH 逐渐增大 B. 溶液中的 c(OH-)逐渐减小
C. 醋酸的电离程度逐渐增大 D. 溶液的导电能力逐渐减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是25℃时某些盐的浓度积常数和弱酸的电离平衡常数,下列说法正确的是( )
化学式 | AgCl | Ag2CrO4 | CH3COOH | HClO | H2CO3 |
Ksp或Ka | Ksp=1.8×10-10 | Ksp=2.0×10-12 | Ka=1.8×10-5 | Ka=3.0×10-8 | Ka1=4.1×10-7 Ka2=5.6×10-11 |
A.相同浓度CH3COONa和NaClO的混合液中,各离子浓度的大小关系是
c(Na+)>c(ClO-)>c(CH3COO-)>c(OH-)>c(H+)
B.碳酸钠溶液中滴加少量氯水的离子方程式H2O+2CO32-+Cl2=2HCO3-+Cl-+ClO-
C.向0.1mol/LCH3COOH溶液中滴加NaOH溶液至c(CH3COOH):c(CH3COO-)=9:5,此时溶液pH=5
D.向浓度均为1×10-3mol/L的KCl和K2CrO4混合液中滴加1×10-3mol/L的AgNO3溶液,CrO42-先形成沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知常温时Ksp(AgCl)=1.8×10-10,Ksp(AgI)=1.0×10-16,Ksp(Ag2CrO4)=1.1×10-12。下列说法中正确的是( )
A.由于Ksp(AgCl)>Ksp(AgI),所以AgI可以转化为AgCl
B.向Ag2CrO4溶液中加入固体K2CrO4,溶解平衡逆向移动,所以Ag2CrO4的Ksp减小
C.由于Ksp(Ag2CrO4)<Ksp(AgCl),所以沉淀AgCl容易转化为沉淀Ag2CrO4
D.常温下,AgCl饱和溶液中加入NaI,若要使溶液中开始转化为AgI,则NaI的浓度必不低于0.75×10-11 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于石灰石和熟石灰用途的说法中,错误的是
A. 燃煤时加入石灰石,可减少硫氧化物的排放
B. 氯水中加入适量石灰石,可增强氯水的漂白性
C. 酸性土壤中加入适量的熟石灰,可以中和其酸性
D. 盐碱地(含较多NaCl、Na2CO3)中施用熟石灰,可降低土壤的碱性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学研究小组探究外界条件对化学反应mA(g)+nB(g)![]() pC(g)的速率和平衡的影响图象如下,下列判断正确的是( )
pC(g)的速率和平衡的影响图象如下,下列判断正确的是( )
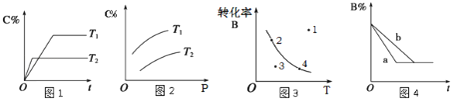
A.由图1可知,T1<T2,该反应正反应为吸热反应
B.由图2可知,该反应m+n<p
C.图3中,表示反应速率v正>v逆的是点3
D.图4中,若m+n=p,则a曲线一定使用了催化剂
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com