
 某课外小组分别用图所示装置对原电池和电解池原理进行实验探究.
某课外小组分别用图所示装置对原电池和电解池原理进行实验探究.分析 Ⅰ.(1)A是原电池的负极,发生氧化反应,电极发生反应的电极反应式为CH4-8e-+10OH-=CO32-+7H2O;
(2)N极与电源的负极相连是电解池的阴极,发生还原反应,所以电极反应式为2H++2e-=H2↑;
(3)图2中阳极铁失去电子变成亚铁离子,亚铁离子与氢氧根离子结合成氢氧化亚铁,氢氧化亚铁迅速被氧化成红褐色沉淀氢氧化铁沉淀;
(4)根据整个过程转移电子数相等,分析解答;
(5)电解过程中,阴极上氢离子放电生成氢气,则阴极附近氢氧根离子浓度大于氢离子溶液,溶液呈碱性;
(6)铁是活泼金属,电解池工作时,阳极上铁失电子发生氧化反应,氢氧根离子失电子发生氧化反应,所以发生的电极反应式为:Fe-6e-+8OH-═FeO42-+4H2O和4OH--4e-═2H2O+O2;
(7)X电极上析出的是氢气,Y电极上析出的是氧气,且Y电极失电子进入溶液,设铁质量减少为xg,根据转移电子数相等得$\frac{0.672L}{22.4L/mol}$×2=$\frac{0.168L}{22.4L/mol}$×4+
$\frac{xg}{56g/mol}$×6;
(8)在碱性锌电池中,锌做负极发生氧化反应,K2FeO4在正极发生还原反应生成氧化铁,据此书写电极反应式,注意电解质溶液为碱性溶液.
解答 解:Ⅰ.(1)A是原电池的负极,发生氧化反应,电极发生反应的电极反应式为CH4-8e-+10OH-=CO32-+7H2O,故答案为:CH4-8e-+10OH-=CO32-+7H2O;(1)A
(2)N极与电源的负极相连是电解池的阴极,发生还原反应,所以电极反应式为2H++2e-=H2↑,故答案为:2H++2e-=H2↑;
(3)图2中阳极铁失去电子变成亚铁离子,亚铁离子与氢氧根离子结合成氢氧化亚铁,氢氧化亚铁迅速被氧化成红褐色沉淀氢氧化铁沉淀,故答案为:滤纸上有红褐色斑点产生;
(4)根据转移电子数相等可得:CH4~8e-~4H2,
1 4
11.2L 44.8L
故答案为:44.8L;
(5)电解过程中,阴极上氢离子放电生成氢气,则阴极附近氢氧根离子浓度大于氢离子溶液,溶液呈碱性,溶液的pH增大,故答案为:增大;
(6)铁是活泼金属,电解池工作时,阳极上铁失电子发生氧化反应,氢氧根离子失电子发生氧化反应,所以发生的电极反应式为:Fe-6e-+8OH-═FeO42-+4H2O和4OH--4e-═2H2O+O2↑,故答案为:4OH--4e-═2H2O+O2↑;
(7)X电极上析出的是氢气,Y电极上析出的是氧气,且Y电极失电子进入溶液,设铁质量减少为xg,根据转移电子数相等得$\frac{0.672L}{22.4L/mol}$×2=$\frac{0.168L}{22.4L/mol}$×4+
$\frac{xg}{56g/mol}$×6,解得x=0.28g,故答案为:0.28;
(8)在碱性锌电池中,锌做负极发生氧化反应,K2FeO4在正极发生还原反应生成氧化铁,正极的电极反应式为2FeO42ˉ+6eˉ+5H2O=Fe2O3+10OHˉ,
故答案为:2FeO42ˉ+6eˉ+5H2O=Fe2O3+10OHˉ.
点评 本题考查了原电池和电解池原理,为高频考点,侧重于学生的分析能力的考查,注意电解池中如果活泼金属作阳极,则电解池工作时阳极材料失电子发生氧化反应,为易错点,难度中等;


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 有关离子 | Fe2+ | Fe3+ | Cr3+ |
| 完全沉淀为对应氢氧化物的pH | 9.0 | 3.2 | 5.6 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.2 mol•L-1CH3COONa溶液和0.1 mol•L-1HCl溶液等体积混合后:c(CH3COO-)>c(Na+)>c(Cl-)>c(H+)>c(OH-) | |
| B. | pH=3的盐酸和NaOH的混合溶液中:c(Na+)=c(Cl-) | |
| C. | 0.1 mol•L-1NaHCO3 溶液中:c(Na+)+c(H+)=c(HCO3-)+c(CO32-)+c(OH-) | |
| D. | 含SO42-、NH4+、H+、OH-的溶液中可能存在:c(H+)>c(SO42-)>c(NH4+)>c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
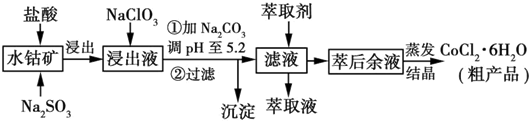
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 | Mn(OH)2 |
| 开始沉淀 | 2.7 | 7.6 | 7.6 | 4.0 | 7.7 |
| 完全沉淀 | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 |
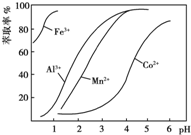
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 配制100mL2mol/LNaCl溶液,将称量的NaCl放入烧杯中加20-30mL的蒸馏水搅拌溶解 | |
| B. | 蒸馏操作时,应将温度计插入烧瓶中的溶液中 | |
| C. | 测溶液的pH时,将pH试纸放入溶液中观察其颜色变化,跟标准比色卡比较 | |
| D. | 分液操作时,先将分液漏斗中的下层液体放出,然后再将上层液体放出 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氢氧化钠溶液 | B. | 通入二氧化碳 | C. | 氢氧化钙溶液 | D. | 盐酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 原溶液中一定含有SO42- | B. | 原溶液中一定含有NH4+ | ||
| C. | 原溶液中一定含有Cl- | D. | 原溶液中一定含有Fe3+ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com