

分析 (1)根据Fe、Fe3O4能被磁铁吸附来回答;
(2)取少量X放入装有足量硫酸铜溶液的烧杯中,铁和硫酸铜反应生成亚铁离子,四氧化三铁和硫酸铜不反应,有少量红色物质析出为置换出的铜,过滤后将滤渣加入到盐酸中,铜和盐酸不反应,四氧化三铁可以和盐酸反应,铁离子遇到硫氰化钾显示血红色;
(3)①黑色粉末加入过量盐酸溶解后,加入加入H2O2时,亚铁离子被氧化成铁离子,加入足量氨水沉淀离子,操作Z是过滤、洗涤得到沉淀,灼烧沉淀在坩埚内烧制;
②依据反应的化学方程式,结合铁元素守恒计算判断.
解答 解:(1)黑色粉末能被磁铁吸附,Fe、Fe3O4能被磁铁吸附,故不能由此确定X就是铁单质,
故答案为:不可靠,因为磁铁矿也有磁性,能被磁铁吸引;
(2)①滴加几滴KSCN溶液,溶液出现血红色,可以证明存在Fe3+,进而证明黑色固体中含有四氧化三铁,确认Fe3O4的存在,
故答案为:检验三价铁离子,进而验证四氧化三铁存在;
②X的组成是Fe和Fe3O4,向其中加入盐酸,Fe3O4溶于其中得到氯化铁溶液会和金属铁之间反应得到氯化亚铁,即Fe+2Fe3+=3Fe2+,不会使KSCN变色,
故答案为:Fe+2Fe3+=3Fe2+;
(3)①流程是黑色粉末加入过量盐酸溶解后,加入加入H2O2溶液与二价铁离子发生氧化还原反应,反应的离子方程式为:2Fe2++2H++H2O2=2Fe3++2H2O,加入足量碱离子全部沉淀,操作Z是过滤、洗涤得到沉淀,洗涤得到沉淀,放在坩埚内灼烧制恒重得到红褐色固体为氧化铁;
故答案为:2Fe2++2H++H2O2=2Fe3++2H2O;过滤;坩埚;
②发生Fe+Fe3O4$\stackrel{足量盐酸}{→}$FeCl2、FeCl3$\stackrel{H_{2}O_{2}}{→}$Fe3+$\stackrel{足量碱}{→}$Fe(OH)2 Fe(OH)3$\stackrel{灼烧恒重}{→}$Fe2O3;依据反应过程中铁元素守恒,3.2gFe2O3物质的量=$\frac{3.2g}{160g/mol}$=0.02mol;设铁物质的量为X,四氧化三铁物质的量为Y,得到:56X+232Y=2.88,X+3Y=0.02×2,解方程得到X=0.01mol;Y=0.01mol;
即n(Fe3O4)=0.01mol;n(Fe)=0.01mol.
故答案为:n(Fe3O4)=0.01mol、n(Fe)=0.01mol.
点评 本题考查了探究物质组成,测定物质含量的定量实验操作和实验设计,主要考查铁及其化合物的性质应用,实验基本操作的分析判断,实验现象的推断和应用,元素守恒的计算应用,综合性较强,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | v1增大,v2减小 | B. | v1减小,v2增大 | C. | 同时增大 | D. | 同时减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
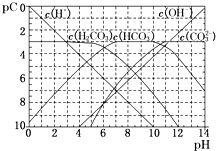 研究碳及其化合物的利用对促进低碳社会的构建具有重要的意义.某学习小组查阅资料并进行相关探究,请帮忙完成以下探究.
研究碳及其化合物的利用对促进低碳社会的构建具有重要的意义.某学习小组查阅资料并进行相关探究,请帮忙完成以下探究.查看答案和解析>>
科目:高中化学 来源: 题型:推断题
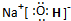 ,写出③中生成盐的化学键类型离子键和共价键.
,写出③中生成盐的化学键类型离子键和共价键.| 物质 | F(OH)2 | I(OH)3 |
| Ksp | 5.61×10-12 | 2.64×10-39 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径X>Y | B. | 氢化物稳定性H2X>HY | ||
| C. | 原子核内质子数R<M | D. | 溶液碱性R(OH)2<M(OH)2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②③④⑤ | B. | ①③④⑤⑥ | C. | ①②④⑤ | D. | ①②③④ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com