
不同元素的原子电负性不同,若用![]() 值来表示,
值来表示,![]() 值越大,其原子的电负性就越大,吸引电子的能力越强,在所形成的分子中成为带负电荷的一方,下面是某些短同期元素的电负性的值:
值越大,其原子的电负性就越大,吸引电子的能力越强,在所形成的分子中成为带负电荷的一方,下面是某些短同期元素的电负性的值:

(1)通过分析![]() 值的变化规律,确定N、Mg的
值的变化规律,确定N、Mg的![]() 值的范围: <
值的范围: <![]() (Mg)< , <
(Mg)< , <![]() (N)< 。?
(N)< 。?
(2)推测![]() 值与原子半径的关系是 。?
值与原子半径的关系是 。?
(3)某有机物结构简式为 ,其中S—N中,你认为共用电子对偏向
,其中S—N中,你认为共用电子对偏向
(即哪个原子显负电性)。?
(4)经验规律告诉我们,当成键的两原子的![]() 差值即Δ
差值即Δ![]() >1.7时,一般为离子键,当Δ
>1.7时,一般为离子键,当Δ![]() <1.7时,一般为共价键。试推断AlBr3中化学键的类型为 。?
<1.7时,一般为共价键。试推断AlBr3中化学键的类型为 。?
(5)预测元素周期表中![]() 值最小的元素是 (放射性元素除外)。?
值最小的元素是 (放射性元素除外)。?
解析:(1)根据电负性在周期表中的递变规律:同一周期从左向右电负性增大,同一主族从上到下电负性减小,可知0.93<![]() (Mg)<1.57,2.55<
(Mg)<1.57,2.55<![]() (N)<3.44。?
(N)<3.44。?
(3)S—N中,N的电负性大,N原子吸引电子的能力强,共用电子对偏向N原子。?
(4)由图中数据可知AlCl3的Δ![]() <1.7,由电负性的递变规律知
<1.7,由电负性的递变规律知![]() (Br)<
(Br)<![]() (Cl),所以可推断AlBr3中Δ
(Cl),所以可推断AlBr3中Δ![]() <1.7,化学键的类型为共价键。?
<1.7,化学键的类型为共价键。?
(5)元素周期表中![]() 值最小的元素是周期表的左下角Cs。?
值最小的元素是周期表的左下角Cs。?
答案:(1)0.93 1.57 2.55 3.44 (2)电负性随原子半径的增大而减小 ?(3)N原子 (4)共价键 (5)Cs(周期表的左下角)


科目:高中化学 来源: 题型:
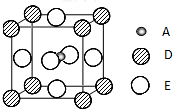 (2010?泰州三模)已知:A、B、C、D、E为周期表1~36号中的元素,它们的原子序数逐渐增大.A的基态原子有3个不同的能级,各能级中电子数相等;C的基态原子2p能级上的未成对电子数与A原子相同;C2-离子D2+离子具有相同的、稳定的电子层结构;E的基态原子的外围电子排布式为3d84s2.
(2010?泰州三模)已知:A、B、C、D、E为周期表1~36号中的元素,它们的原子序数逐渐增大.A的基态原子有3个不同的能级,各能级中电子数相等;C的基态原子2p能级上的未成对电子数与A原子相同;C2-离子D2+离子具有相同的、稳定的电子层结构;E的基态原子的外围电子排布式为3d84s2.查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
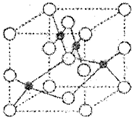
查看答案和解析>>
科目:高中化学 来源: 题型:
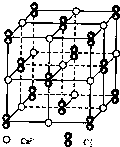 已知A、B、C、D、E五种元素的原子序数依次增大,其中A原子所处的周期数、族序数都与其原子序数相等;B原子核外电子有6种不同的运动状态,S轨道电子数是P轨道电子数的两倍;D原子L层上有2时成对电子;E+原子核外有3层电子且M层3d轨道电子全充满.请回答下列问题:
已知A、B、C、D、E五种元素的原子序数依次增大,其中A原子所处的周期数、族序数都与其原子序数相等;B原子核外电子有6种不同的运动状态,S轨道电子数是P轨道电子数的两倍;D原子L层上有2时成对电子;E+原子核外有3层电子且M层3d轨道电子全充满.请回答下列问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com