
| 实验序号 | 加入试剂 | 实验现象 |
| Ⅰ | 4mL 2mol/L NH4Cl 溶液 | 沉淀溶解 |
| Ⅱ | 4mL蒸馏水 | 沉淀不溶解 |
| 序号 | 实验内容 | 结 果 |
| 1 | 测定醋酸铵溶液的pH | pH约为7,溶液呈中性 |
| 2 | 取少量的相同质量的氢氧化镁分别盛放在试管中,分别向其中滴加醋酸铵溶液和氯化铵溶液 | 固体均溶解 |
分析 (1)氯化铵溶液中,铵根离子结合水电离的氢氧根离子,溶液显示酸性;
(2)氢氧化镁能溶解在氯化铵中有两种可能性,一是水解呈酸性的原因,二是氢氧化镁电离出的氢氧根离子与铵根离子反应,据此进行解答;
(3)醋酸铵为中性,如果醋酸铵能够溶解氢氧化镁固体,则证明猜想1正确;
(4)假如溶剂水能够溶解氢氧化镁,对该实验探究会产生影响,据此进行解答.
解答 解:(1)NH4Cl为强酸弱碱盐,铵根离子水解,溶液呈酸性,水解的离子方程式为:NH4++H2O?NH3•H2O+H+,
故答案为:NH4++H2O?NH3•H2O+H+;
(2)氢氧化镁能溶解在氯化铵中有两种可能性,一是氢氧化镁电离出OH-离子,与氯化铵电离出来的铵根离子反应生成氨水,二可能是铵根离子水解呈酸性,氢离子与氢氧根离子反应生成水,
故答案为:氯化铵中NH4+离子水解出的H+,与氢氧化镁电离出OH-离子生成了水;
(3)①醋酸铵溶液呈中性,如果氢氧化镁能溶解于醋酸铵,说明是NH4+结合氢氧化镁电离出的OH-离子,导致沉淀溶解平衡移动正向移动,达到沉淀溶解,则证明猜想1是正确的,否则猜想2正确,
故答案为:醋酸铵溶液呈中性,如果氢氧化镁能溶解于醋酸铵,说明是NH4+结合氢氧化镁电离出的OH-离子,导致沉淀溶解平衡移动正向移动,达到沉淀溶解;
②根据①可知,氢氧化镁存在溶解平衡,Mg(OH)2(s)?Mg2+(aq)+2OH-(aq),铵根离子结合氢氧化镁电离的氢氧根离子,氢氧化镁的溶解平衡右移,导致氢氧化镁沉淀,所以猜想1正确,
故答案为:1;
(4)实验Ⅱ,加入等体积的水,观察到沉淀不溶解,可以排除实验中溶剂水使沉淀溶解的可能性,使实验结果更具有说服力,
故答案为:做对比分析,排除实验中溶剂水使沉淀溶解的可能性.
点评 本题考查较为综合,侧重于学生的分析能力和实验能力的考查,为高频考点,题目难度中等,注意把握影响沉淀平衡,电离平衡和水解平衡的因素,综合把握相关基本理论知识,注重基础知识的学习.


科目:高中化学 来源: 题型:解答题
| 实验组 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所 需时间/min | ||
| H2O | CO | H2 | CO | |||
| 1 | 650 | 2 | 4 | 1.6 | 2.4 | 5 |
| 2 | 900 | 1 | 3 | 0.75 | 2.25 | 3 |
| 3 | 900 | 2 | 4 | x | y | t |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C02分子中σ键和π键之比为1:1 | |
| B. | PCl5中所有原子均满足8电子稳定结构 | |
| C. | 由于HCOOH分子间存在氢键,则同压下,HC00H的沸点比CH3OCH3的高 | |
| D. | CH2=CH-CHO分子中碳原子的杂化类型均为sp2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 若甲为铜,丁为氯化亚铁,则该反应为置换反应 | |
| B. | 若甲为碳,丁为硅,则丙一定是二氧化碳 | |
| C. | 若甲为铝,丁为三氧化二铝,则丙可能是镁 | |
| D. | 若甲为NH4+,乙为OH-,则甲、乙、丙、丁4种粒子均含10个电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
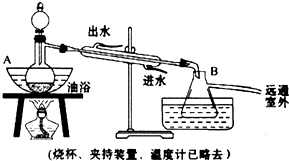 后静置,放出水层(废液).
后静置,放出水层(废液).查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 向氨水中滴入稀硫酸:H++OH-═H2O | |
| B. | 向硫酸铝溶液中滴入过量的氨水:Al3++4OH-═AlO2-+2H2O | |
| C. | 向饱和氨水中通过量的CO2气体:NH3+H2O+CO2═NH4++HCO3- | |
| D. | 向氯化铵的稀溶液中滴入少量的NaOH溶液:NH4++OH-═NH3•H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ,它的分子式是C10H22
,它的分子式是C10H22查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com