
【题目】实验室中有一未知浓度的稀盐酸,某学生为测定该盐酸的浓度在实验室中进行实验。请完成下列填空:
(1)配制100mL0.10mol/LNaOH标准溶液。
①主要操作步骤:计算→称量→溶解→(冷却后)__→洗涤(并将洗涤液移入容量瓶)→__→摇匀→将配制好的溶液倒入试剂瓶中,贴上标签。
②称量__g氢氧化钠固体所需仪器有:天平(带砝码、镊子)、___、__。
(2)取20.00mL待测盐酸溶液放入锥形瓶中,并滴加2~3滴酚酞作指示剂,用自己配制的标准液NaOH溶液进行滴定。重复上述滴定操作2~3次,记录数据如下:
实验编号 | NaOH溶液的浓度(mol/L) | 滴定完成时,NaOH溶液滴入的体积(mL) | 待测盐酸溶液的体积(mL) |
1 | 0.10 | 22.62 | 20.00 |
2 | 0.10 | 22.72 | 20.00 |
3 | 0.10 | 22.80 | 20.00 |
①滴定达到终点的标志是___。
②根据上述数据,可计算出该盐酸的浓度约为__(保留两位有效数字)。
③排去碱式滴定管中气泡的方法应采用如图所示操作中的__,然后轻轻挤压玻璃球使尖嘴部分充满碱液。

④在上述实验中,下列操作(其他操作正确)会造成测定结果偏高的有:___。
A.滴定终点读数时俯视读数
B.酸式滴定管使用前,水洗后未用待测盐酸溶液润洗
C.锥形瓶水洗后未干燥
D.称量NaOH固体中混有Na2CO3固体
E.配制好的NaOH标准溶液保存不当,部分与空气中的CO2反应生成了Na2CO3
F.碱式滴定管尖嘴部分有气泡,滴定后消失
【答案】转移 定容 0.4 烧杯(或表面皿) 药匙 最后一滴NaOH溶液加入,溶液由无色恰好变成浅粉红色,并且半分钟不褪色 0.11mol/L 丙 D、F
【解析】
(1)①配制一定体积一定物质的量浓度的溶液的操作步骤是计算→称量→溶解→(冷却后)转移→洗涤(并将洗涤液移入容量瓶)→定容→摇匀→装瓶→贴签;
②n(NaOH)=0.100L×0.10mol/L=0.01mol,m(NaOH)=0.01mol×40g/mol=0.4g,因此要称量0.4g NaOH。所需仪器有:天平(带砝码、镊子)、烧杯、药匙;
(2)①由于是用已知浓度的碱滴定未知浓度的酸,所以指示剂在酸溶液中,当滴定达到终点时会看到溶液由无色变为红色,且半分钟内不褪色即可确定滴定达到了终点;
②V(NaOH)=(22.62+22.72+22.80)mL÷3=22.71mL,因为HCl恰好反应时物质的量的比为1:1.所以c(HCl)=(0.10mol/L×22.71mL)÷20.00mL=0.11mol/L;
③排去碱式滴定管中气泡的方法应采用如图所示操作中的丙操作,然后轻轻挤压玻璃球使尖嘴部分充满碱液;
④A.滴定终点读数时俯视读数,会使读数偏小,所以测定结果偏低,选项A错误;
B.酸式滴定管使用前,水洗后未用待测盐酸溶液润洗,会使酸式滴定管内的盐酸浓度变小,导致中和20.00mL的盐酸的氢氧化钠溶液体积减小,测定该盐酸的浓度就一定偏低,选项B错误;
C.锥形瓶水洗后未干燥,实际不影响加入的氢氧化钠的体积,所以无影响,选项C错误;
D.称量NaOH固体中混有Na2CO3固体,1mol氢氧化钠中和1mol盐酸,1mol碳酸钠中和2mol盐酸,即质量相等的前提下,氢氧化钠反应的盐酸会更多,所以NaOH固体中混有Na2CO3固体,实际降低了其反应盐酸的能力,但是计算时仍然以为都是氢氧化钠,就会将盐酸浓度算大,选项D正确;
E.1mol氢氧化钠中和1mol盐酸,转化为0.5mol碳酸钠也中和1mol盐酸,所以配制好的NaOH标准溶液保存不当,部分与空气中的CO2反应生成了Na2CO3,实际不影响等体积的溶液中和盐酸的能力,测定结果应该不变,选项E错误;
F.碱式滴定管尖嘴部分有气泡,滴定后消失,则读数的体积是滴入溶液中的氢氧化钠体积和原来的气泡的体积,所以测定结果偏高,选项F正确;
故选择DF。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】短周期元素W、X、Y、Z的原子序数依次递增,a、b、c、d、e、f是由这些元素组成的化合物,d为离子化合物,其结构中还含非极性共价键,m为元素Y的单质,通常为无色无味的气体。上述物质的转化关系如图所示。下列说法正确的是

A. 原子半径:W<X<Y<Z
B. 阴离子的还原性:Y>W
C. 图中物质的转化过程均为氧化还原反应
D. a一定由W、X两种元素组成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,0.1000mol·L-1的盐酸逐滴加入到20.00mL 0.1000mol·L-1的氨水中,溶液的pH和pOH[注:pOH=-lgc(OH-)]与所加盐酸体积的关系如图所示,下列说法中不正确的是( )
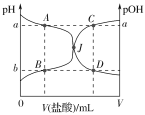
A.图中a+b=14
B.交点J点对应的V(HCl)=20.00 mL
C.点A、B、C、D四点的溶液中均存在如下关系:c(Cl-)-c(NH4+)=c(H+)-c(OH-)
D.若在绝热体系中发生上述反应,图中的交点J向右移
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应中属于可逆反应的是( )
①N2+3H2![]() 2NH3,2NH3
2NH3,2NH3![]() 3H2+N2
3H2+N2
②2NaHCO3![]() Na2CO3+H2O↑+CO2↑,Na2CO3+H2O+CO2===2NaHCO3
Na2CO3+H2O↑+CO2↑,Na2CO3+H2O+CO2===2NaHCO3
③CH3CH2OH![]() CH2===CH2↑+H2O,CH2===CH2+H—OH
CH2===CH2↑+H2O,CH2===CH2+H—OH![]() CH3CH2OH
CH3CH2OH
④2Na+Cl2![]() 2NaCl, 2NaCl
2NaCl, 2NaCl![]() 2Na+Cl2
2Na+Cl2
A.只有①B.①②③
C.①②③④D.①③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学生设计下列实验(图中用于加热的仪器没有画出)制取Mg3N2,观察到装置A的黑色的固体变成红色,装置D的镁条变成白色,回答下列问题:
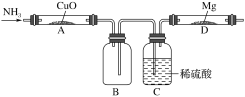
(1)装置A中生成的物质是纯净物,则可能是_________,证明的方法是_____________。
(2)设计C装置的作用是________________,缺陷是___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】水煤气变换反应为:CO(g)+H2O(g)=CO2(g)+H2(g)。我国学者结合实验与计算机模拟结果,研究了在金催化剂表面上水煤气变换的反应历程,如图所示,其中吸附在金催化剂表面上的物种用![]() 标注。下列说法正确的是( )
标注。下列说法正确的是( )
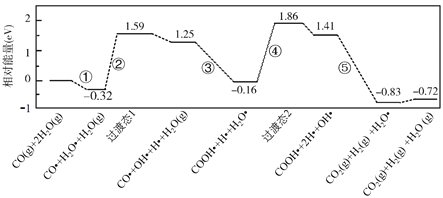
A.水煤气变换反应的ΔH>0
B.步骤③的化学方程式为:CO●+OH●+H2O(g)=COOH●+H2O●
C.步骤⑤只有非极性键H-H键形成
D.该历程中最大能垒(活化能)E正=1.70eV
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关如图所示化合物X的说法错误的是
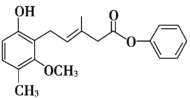
A.X的分子式是C20H20O
B.1 mol该化合物最多可以与3mol NaOH溶液反应
C.X能使酸性高锰酸钾溶液和溴水褪色
D.X在酸性下的两种水解产物都可以与FeCl3溶液发生显色反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚硝酸钠![]() 是一种工业盐,外观与食盐相似。下面是某学习小组设计的
是一种工业盐,外观与食盐相似。下面是某学习小组设计的![]() 制取实验和纯度检验实验。该小组收集了相关资料:
制取实验和纯度检验实验。该小组收集了相关资料:
![]() 和
和![]() 溶液反应生成
溶液反应生成![]() 和
和![]() 为淡黄色接近白色固体,在水中形成沉淀
为淡黄色接近白色固体,在水中形成沉淀![]()
Ⅰ![]() 亚硝酸钠的制取实验
亚硝酸钠的制取实验
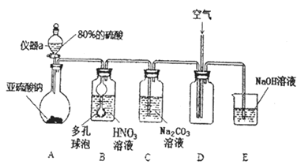
![]() 仪器a的名称为___________,A装置中发生的化学反应方程式为________________。
仪器a的名称为___________,A装置中发生的化学反应方程式为________________。
![]() 装置中多孔球泡的作用_________________________。
装置中多孔球泡的作用_________________________。
![]() 若装置B中逸出的NO与
若装置B中逸出的NO与![]() 气体物质的量之比为
气体物质的量之比为![]() ,则装置B中发生反应的化学方程式为_______。
,则装置B中发生反应的化学方程式为_______。
![]() 实验过程中需控制C装置中溶液
实验过程中需控制C装置中溶液![]() ,否则C中生成的
,否则C中生成的![]() 的产量会下降,理由是_______________。
的产量会下降,理由是_______________。
![]() 请根据题干所给信息设计实验证明C装置中有
请根据题干所给信息设计实验证明C装置中有![]() 产生:__________。
产生:__________。 ![]() 限选用的试剂:稀硝酸、硝酸银溶液、NaOH溶液
限选用的试剂:稀硝酸、硝酸银溶液、NaOH溶液![]()
Ⅱ![]() 亚硝酸钠的纯度检验
亚硝酸钠的纯度检验
已知:![]()
![]()
![]()
![]() span>
span>![]()
![]() 反应结束后C中溶液通过结晶获得
反应结束后C中溶液通过结晶获得![]() 粗产品mg,溶解后稀释至250mL,分别取
粗产品mg,溶解后稀释至250mL,分别取![]() 用
用![]() 的酸性
的酸性![]() 溶液平行滴定三次,平均每次消耗酸性
溶液平行滴定三次,平均每次消耗酸性![]() 溶液的体积为VmL。则粗产品中
溶液的体积为VmL。则粗产品中![]() 的质量分数为_______
的质量分数为_______![]() 用含c、V、m的式子表示
用含c、V、m的式子表示![]() 。
。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】《茉莉花》是首脍炙人口的江苏民歌。乙酸苯甲酯可以从茉莉花中提取,也可用如图路线合成:
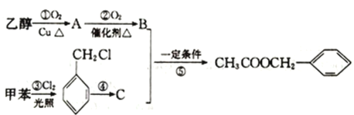
(1)乙酸苯甲酯的分子式为__,C的结构简式为__,B中所含官能团的名称为__,③的反应类型为___。
(2)①的化学方程式为___。
(3)乙酸苯甲酯与NaOH溶液反应的化学方程式为___。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com