

 ,K的结构简式为
,K的结构简式为 .
.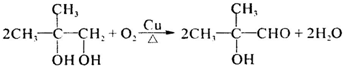 .
. $→_{△}^{浓H_{2}SO_{4}}$
$→_{△}^{浓H_{2}SO_{4}}$ +H2O.
+H2O.分析 由C→D→E的转化可知,E中含有-COOH,D中含有醛基,C中含有羟基,E在浓硫酸、加热条件下可以得到F或G,G与NH3反应生成H,而H是丙烯酰胺的相邻同系物,则E中还含有-OH,C中存在不能被氧化的羟基,又E发生消去反应生成F,F又为三元环状化合物,所以E中羧基、羟基连接同一碳原子上,故E为 ,F为
,F为 ,E发生消去反应生成G,G与NH3反应生成H,H是丙烯酰胺的相邻同系物,则H为
,E发生消去反应生成G,G与NH3反应生成H,H是丙烯酰胺的相邻同系物,则H为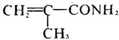 ,G为
,G为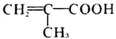 ,H发生加聚反应可以得到K为
,H发生加聚反应可以得到K为 ;逆推可知D为
;逆推可知D为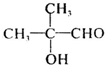 ,C为
,C为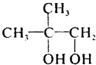 ,A为
,A为 ,A转化B可以是与溴发生加成反应生成B,据此解答.
,A转化B可以是与溴发生加成反应生成B,据此解答.
解答 解:(1)由上述分析可知,D为 ,所含有的官能团为羟基和醛基,故答案为:羟基和醛基;
,所含有的官能团为羟基和醛基,故答案为:羟基和醛基;
(2)由上述分析可知,A的结构简式为 ,K的结构简式为
,K的结构简式为 ,
,
故答案为: ;
; ;
;
(3)A→B以是与溴发生加成反应生成B,E→G是 发生消去反应生成
发生消去反应生成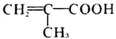 ,故答案为:加成反应;消去反应;
,故答案为:加成反应;消去反应;
(4)C→D的反应方程式为: ,
,
E→F的反应方程式为: $→_{△}^{浓H_{2}SO_{4}}$
$→_{△}^{浓H_{2}SO_{4}}$ +H2O,
+H2O,
故答案为: ;
; $→_{△}^{浓H_{2}SO_{4}}$
$→_{△}^{浓H_{2}SO_{4}}$ +H2O;
+H2O;
(5)①能发生银镜反应,说明含有醛基;
②能与金属钠反应放出H2,所以含有羟基或者羧基;
③能发生水解反应,说明含有酯基;
E为 ,共含有3个氧原子,1个不饱和度,所以醛基和酯基合并为甲酸酯,还剩一个氧原子,只能为羟基,则符合条件的同分异构体有HCOOCH2-CH2-CH2-OH,HCOOCH(OH)CH2-CH3,HCOOCH2-CH(OH)CH3,HCOOCH(CH3)CH2(OH),HCOOC(OH)(CH3)2共5种,核磁共振氢谱中有3个吸收峰的R的结构简式:HCOOC(OH)(CH3)2,故答案为:5;HCOOC(OH)(CH3)2;
,共含有3个氧原子,1个不饱和度,所以醛基和酯基合并为甲酸酯,还剩一个氧原子,只能为羟基,则符合条件的同分异构体有HCOOCH2-CH2-CH2-OH,HCOOCH(OH)CH2-CH3,HCOOCH2-CH(OH)CH3,HCOOCH(CH3)CH2(OH),HCOOC(OH)(CH3)2共5种,核磁共振氢谱中有3个吸收峰的R的结构简式:HCOOC(OH)(CH3)2,故答案为:5;HCOOC(OH)(CH3)2;
(6)A为 ,A转化B可以是与氯气发生加成反应生成B,则B的分子式为C4H8Cl2,同分异构体为ClCH2-ClCH-CH2-CH3,
,A转化B可以是与氯气发生加成反应生成B,则B的分子式为C4H8Cl2,同分异构体为ClCH2-ClCH-CH2-CH3,
ClCH2-CH2-ClCH-CH3,ClCH2-CH2-CH2-ClCH2,CH3-ClCH2-ClCH-CH3,Cl2CH-CH2-CH2-CH3,CH3-CHCl2-CH2-CH3,Cl2CH-CH(CH3)2,ClCH2-CCl(CH3)2,ClCH2-CH(CH3)(CH2Cl)共9种,故答案为:9.
点评 本题考查有机物推断,根据E发生的反应确定C的结构特点,进而确定的E结构简式,再结合转化关系进行推断,掌握官能团的性质与转化是关键,难度中等.


科目:高中化学 来源: 题型:实验题
| 实验序号 | 实验内容 | 实验结果 |
| 1 | 加入AgNO3溶液 | 有白色沉淀生成 |
| 2 | 加入足量NaOH溶液并加热 | 收集到气体0.896L(换算成标准状况) |
| 3 | 加入足量BaCl2溶液,将所得沉淀洗涤、干燥、称重;再向沉淀中加足量的稀盐酸,洗涤、干燥、称重 | 第一次称重读数为6.27g,第二次称重读数为2.33g |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 物质类别 | 烯烃 | 酚 | 醛 | 硝基化合物 |
| 官能团名称 | 碳碳双键 | 羟基 | 醛基 | 硝基 |
| 结构简式 |  | -OH | -CHO | -NO2 |
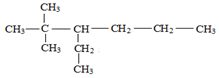 的名称为2,2-二甲基-3-乙基己烷.
的名称为2,2-二甲基-3-乙基己烷.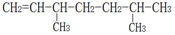 的名称为2,5-二甲基-1-庚烯.
的名称为2,5-二甲基-1-庚烯.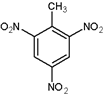 .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | c(Fe3+)=0.1 mol/L溶液中:Na+、NH4+、SCN-、SO42- | |
| B. | 能溶解CaCO3的溶液中:Fe3+、Ca2+、Cl-、NO3- | |
| C. | 由水电离出的c(H+)=1×10-2mol/L的溶液中:Na+、Ba2+、HCO3-、Cl- | |
| D. | 强碱性溶液中:K+、Na+、ClO-、I- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在101kPa下,1g物质完全燃烧所放出的热量叫做该物质的热值 | |
| B. | 把FeCl3的水溶液加热蒸干可得到FeCl3固体 | |
| C. | 用25mL碱式滴定管量取20.00mL高锰酸钾溶液 | |
| D. | 太阳能电池是把太阳能转化为内能的装置 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| NaOH起始读数 | NaOH终点读数 | |
| 第一次 | 0.50mL | 18.60mL |
| 第二次 | 0.70mL | 19.00mL |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com