
| X | 动植物生产不可缺少的元素,是蛋白质的重要成分 |
| Y | 地壳中含量居第一位 |
| Z | 短周期中其原子半径最大 |
| Q | 生活中大量使用其合金制品,工业上可用电解其氧化物的方法制备 |
| M | 海水中大量富集的元素之一,其最高正价与负价的代数和为6 |
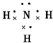 .
.分析 X、Y、Z、Q、M为常见的短周期元素,其原子序数依次增大.X是动植物生长不可缺少的元素,是蛋白质的重要成分,则X为N元素;Y元素在地壳中含量居第一位,则Y为O元素;Z是短周期中其原子半径最大,则Z为Na元素;Q是生活中大量使用其合金制品,工业上可用电解其氧化物的方法制备,则Q为Al元素;M是海水中大量富集的元素之一,其最高正化合价与负价的代数和为6,处于短周期,则M为Cl元素,据此解答.
解答 解:X、Y、Z、Q、M为常见的短周期元素,其原子序数依次增大.X是动植物生长不可缺少的元素,是蛋白质的重要成分,则X为N元素;Y元素在地壳中含量居第一位,则Y为O元素;Z是短周期中其原子半径最大,则Z为Na元素;Q是生活中大量使用其合金制品,工业上可用电解其氧化物的方法制备,则Q为Al元素;M是海水中大量富集的元素之一,其最高正化合价与负价的代数和为6,处于ⅦA,则M为Cl元素,
(1)X为N元素,X的气态氢化物的大量生产曾经解决了地球上因粮食不足而导致的饥饿和死亡问题,该气体为氨气,分子中氮原子与氢原子之间形成1对共用电子对,电子式为 ,故答案为:
,故答案为: ;
;
(2)A.同周期自左而右原子半径减小,故原子半径:Rb>I,故A正确;
B.RbCl属于离子化合物,含有离子键,不含共价键,故B错误;
C.非金属性Cl>I,故气态氢化物热稳定性:Cl>I,故C正确;
D.氢氧化铷是强碱,高氯酸是强酸,氢氧化铝是两性氢氧化物,与氢氧化铷、高氯酸反应生成相应的盐与水,氢氧化铷、高氯酸发生中和反应,故D正确;
故答案为:ACD;
(3)X、Y组成的一种无色气体遇空气变为红棕色.该无色气体为NO,将标准状况下40L该无色气体与15L氧气通入一定浓度的NaOH溶液中,恰好被完全吸收,同时生成两种盐,氮元素被氧化,生成硝酸盐、亚硝酸盐,令生成的被氧化为硝酸盐、亚硝酸盐的NO的体积分别为xL、yL,则:x+y=40,根据电子转移守恒有:3x+y=15×4,联立解得x=10,y=30,故生成的硝酸盐、亚硝酸盐物质的量之比=10L:30L=1:3,反应离子方程式为:8NO+3O2+8OH-=2NO3-+6NO2-+4H2O,故答案为:8NO+3O2+8OH-=2NO3-+6NO2-+4H2O.
点评 本题考查结构性质位置关系、常用化学用语、热化学方程式书写、氧化还原反应等,难度中等,(3)中注意利用电子转移守恒确定硝酸盐、亚硝酸盐的物质的量之比.


 习题精选系列答案
习题精选系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铝和氢氧化钠溶液反应:2Al+2OH-=2AlO2-+H2↑ | |
| B. | 铜与足量FeCl3溶液反应:Fe3++Cu=Fe2++Cu2+ | |
| C. | 用醋酸除去水瓶中的水垢:CaCO3+2H+=Ca2++H2O+CO2↑ | |
| D. | 向苯酚钠溶液中通入CO2:C6H5O-+CO2+H2O→C6H5OH+HCO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
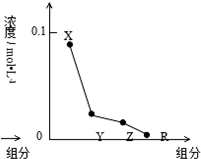 常温下,0.2mol•L-1的一元酸HCl与等浓度的MOH溶液等体积混合后,所得溶液中部分微粒组成及浓度如图所示,下列说法正确的是( )
常温下,0.2mol•L-1的一元酸HCl与等浓度的MOH溶液等体积混合后,所得溶液中部分微粒组成及浓度如图所示,下列说法正确的是( )| A. | MOH为强碱 | |
| B. | 该混合液pH=7 | |
| C. | 该混合溶液中:c(Cl-)=c(M+) | |
| D. | 图中X表示M+,Y表示H+,Y表示MOH,R表示OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
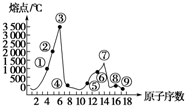 如图是部分短周期元素的单质熔点的变化图,根据此图,填写下列空格:
如图是部分短周期元素的单质熔点的变化图,根据此图,填写下列空格: .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,22.4L CCl4中含有共用电子对数目为4.0NA | |
| B. | 1 L 0.2 mol•L-1硫酸铁溶液中含有的SO42-数为0.2NA | |
| C. | 1 mol CO2与1 mol Na2O2完全反应时,转移的电子数目为NA | |
| D. | 9.2 g NO2气体中含有分子数目为0.2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
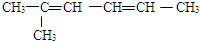 的名称为2-甲基-2,4-己二烯.
的名称为2-甲基-2,4-己二烯.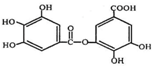 该物质所含官能团的名称分别为羟基、酯基、羧基.
该物质所含官能团的名称分别为羟基、酯基、羧基.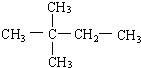 进行一氯取代反应后,只能生成3种沸点不同产物.
进行一氯取代反应后,只能生成3种沸点不同产物.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 陈述Ⅰ | 陈述Ⅱ | |
| A | NaHCO3为强碱弱酸盐,只存在水解平衡 | NaHCO3溶液显碱性 |
| B | HCL与Na2CO3溶液反应生成CO2 | 用饱和NaCO3溶液除去CO2中的少量HCl |
| C | Cl2使润湿的有色布条褪色,而干燥的布条不褪色 | 次氯酸的氧化性比氯气的强 |
| D | 常温下铁、铜均不溶于浓硫酸 | 常温下铁、铜与浓硫酸均不反应 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com