
| A. | 2.24L | B. | 1.12L | C. | 0.672L | D. | 0.448L |
分析 10mL混合酸中含有:n(H+)=0.01L×2×4mol/L+0.01L×2mol/L=0.1mol,n(NO3-)=0.01L×2mol/L=0.02mol,由于铁过量,则发生反应:3Fe+2NO3-+8H+=3Fe2++2NO↑+4H2O,Fe+2H+=Fe2++H2↑,以此计算该题.
解答 解:10mL混合酸中含有:n(H+)=0.01L×2×4mol/L+0.01L×2mol/L=0.1mol,n(NO3-)=0.01L×2mol/L=0.02mol,
由于铁过量,则发生反应:3Fe+2NO3-+8H+=3Fe2++2NO↑+4H2O,Fe+2H+=Fe2++H2↑,则
3Fe+2NO3-+8H+=3Fe2++2NO↑+4H2O
0.02mol 0.08mol 0.02mol
反应后剩余n(H+)=0.1mol-0.08mol=0.02mol,
Fe+2H+=Fe2++H2↑
0.02mol 0.01mol
所以:n(NO)+n(H2)=0.02mol+0.01mol=0.03mol,
V(NO)+V(H2)=0.03mol×22.4L/mol=0.672L,
故选C.
点评 本题考查混合物的计算,题目难度中等,本题注意铁过量,根据n(H+)、n(NO3-)判断反应的可能性,判断生成气体为NO和H2的混合物,进而计算气体的体积.


 天天练口算系列答案
天天练口算系列答案科目:高中化学 来源: 题型:选择题
| A. | △H1>0 | B. | △H2>0 | C. | △H2<△H3 | D. | △H5=2△H4+△H1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 易失去电子的物质 | B. | 原子核外有10个电子的微粒 | ||
| C. | 原子的最外层只有1个电子的元素 | D. | 原子核内有12个质子的元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
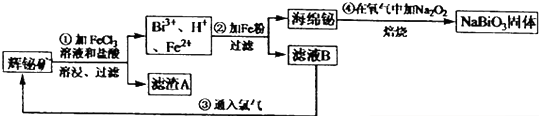
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2 | B. | 2.22 | C. | 3.46 | D. | 4.44 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
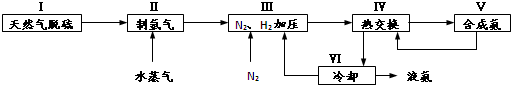
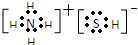 ,写出再生反应的化学方程式:2NH4HS+O2=2S↓+2NH3•H2O.NH3的沸点高于H2S,是因为NH3分子之间存在着一种比分子间作用力更强的作用力.
,写出再生反应的化学方程式:2NH4HS+O2=2S↓+2NH3•H2O.NH3的沸点高于H2S,是因为NH3分子之间存在着一种比分子间作用力更强的作用力.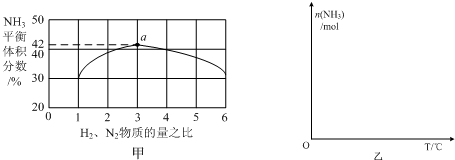
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com