
250 ℃和1.01×105 Pa时,反应2N2O5(g)===4NO2(g)+O2(g) ΔH=+56.76 kJ/mol,自发进行的原因是 ( )
A.是吸热反应 B.是放热反应
C.是熵减反应 D.熵增效应大于能量效应
 一线名师权威作业本系列答案
一线名师权威作业本系列答案科目:高中化学 来源: 题型:
下列说法错误的是( )
A.已知2NO2 N2O4加压后颜色先变深后变浅。
N2O4加压后颜色先变深后变浅。
B. 在密闭容中发生下列反应aA(g) cC(g)+dD(g),反应达到平衡后,将气体体积压缩到原来的一半,当再次达到平衡时,D的浓度为原平衡的1.6倍,故可知A的转化率变小。
cC(g)+dD(g),反应达到平衡后,将气体体积压缩到原来的一半,当再次达到平衡时,D的浓度为原平衡的1.6倍,故可知A的转化率变小。
C.在密闭容器中进行如下反应:X2(g)+Y2(g)  2Z(g),已知X2、Y2、Z的起始浓度分别为0.1mol/L、0.3mol/L、0.2mol/L,在一定条件下,当反应达到平衡时,Z的浓度有可能是0.4 mol/L。
2Z(g),已知X2、Y2、Z的起始浓度分别为0.1mol/L、0.3mol/L、0.2mol/L,在一定条件下,当反应达到平衡时,Z的浓度有可能是0.4 mol/L。
D. 未来新能源的特点是资源丰富,在使用时对环境无污染或污染很小,且可以再生。下列属于未来新能源标准的是⑤⑥⑦⑧。
①天然气 ②煤 ③核能 ④石油 ⑤太阳能 ⑥生物质能 ⑦风能 ⑧氢能
查看答案和解析>>
科目:高中化学 来源: 题型:
下列实验操作完全正确的是( )
| 编号 | 实验 | 操作 |
| A. | 钠与水反应 | 用镊子从煤油中取出金属钠,切下绿豆大小的钠,小心放入装满水的烧杯中 |
| B. | 配制一定浓度的氯化钾溶液1000mL | 准确称取氯化钾固体,放入到1000ml的容量瓶中,加水溶解,振荡摇匀,定容 |
| C. | 证明某溶液中含Fe2+ | 取少量该溶液先加入氯水,再滴加KSCN溶液 |
| D. | 取出分液漏斗中的上层液体 | 下层液体从分液漏斗下端管口放出,及时关闭活塞,换一个接收容器,上层液体从分液漏斗上口倒出 |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列各项内容中,排列顺序正确的是
① 固体的热稳定性:Na2CO3>NaHCO3
② 相同物质的量浓度的下列溶液中NH4+ 的浓度:
(NH4)2SO4>(NH4)2CO3>NH4Cl
③ 微粒半径:K+>S2->F
④ 给出质子的能力:CH3COOH>C2H5OH>H2O
⑤ 氢化物的沸点:H2Se>H2S>H2O
A.①③ B.②④ C.①② D.③⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
氟元素半径小,电负性高,可与金属或非金属生成最高价化合物,如MnF2、SF6等。
(1)写出F-的电子排布式 。
(2)BF3的键角是 ,BF3可与NaF反应生成NaBF4,写出BF4-的结构式 。
(3)OF2可由单质氟与稀NaOH溶液反应来制备。
①OF2分子的空间构型为 。
②OF2可与水缓慢反应,其方程式为 ;Cl2O与OF2互为等电子体,试写出Cl2O与水反应的方程式: 。
③试比较OF2与Cl2O极性的大小,并简单说明原因:
。
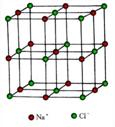 (4)NaF具有与NaCl相同的晶体类型,则F-周围距离最近的Na+所围成的几何体为 ,NaF中Na+与Na+之间的最短距离为d,则NaF晶体的密度为 (阿伏伽德罗常数用NA表示,列出计算式)。
(4)NaF具有与NaCl相同的晶体类型,则F-周围距离最近的Na+所围成的几何体为 ,NaF中Na+与Na+之间的最短距离为d,则NaF晶体的密度为 (阿伏伽德罗常数用NA表示,列出计算式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
LiAl/FeS电池是一种正在开发的车载电池,该电池中正极的电极反应式为:2Li++FeS+2e-===Li2S+Fe,有关该电池的下列说法中正确的是( )。
A.LiAl在电池中作为负极材料,该材料中Li的化合价为+1价
B.该电池的电池反应式为:2Li+FeS===Li2S+Fe
C.负极的电极反应式为:Al-3e-===Al3+
D.充电时,阴极发生的电极反应式为:Li2S+Fe-2e-===2Li++FeS
查看答案和解析>>
科目:高中化学 来源: 题型:
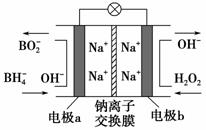
某新型电池,以NaBH4(B的化合价为+3价)和H2O2作原料,该电池可用作深水勘探等无空气环境电源,其工作原理如图所示。下列说法正确的是( )。
A.电池工作时Na+从b极区移向a极区
B.每消耗3 mol H2O2,转移3 mol e-
C.b极上的电极反应式为:
H2O2+2e-+2H+===2H2O
D.a极上的电极反应式为:BH4-+8OH--8e-===BO2-+6H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
中 国第二艘载人飞船神舟六号已于2005年10月12日北京时间9时整发射升空。担任神舟六号发射任务的仍然是长征二号F运载火箭。该运载火箭使用偏二甲肼[NH2N(CH3)2]和四氧化二氮(N2O4)作为推进剂,发生反应后生成N2、CO2和H2O(g)。则该反应中N2O4( )。
国第二艘载人飞船神舟六号已于2005年10月12日北京时间9时整发射升空。担任神舟六号发射任务的仍然是长征二号F运载火箭。该运载火箭使用偏二甲肼[NH2N(CH3)2]和四氧化二氮(N2O4)作为推进剂,发生反应后生成N2、CO2和H2O(g)。则该反应中N2O4( )。
A.只是氧化剂 B.只是还原剂
C.既是氧化剂又是还原剂 D.既不是氧化剂又不是还原剂
查看答案和解析>>
科目:高中化学 来源: 题型:
聚合硫酸铁又称聚铁,化学式为[Fe2(OH)n(SO4)3-0.5n]m,广泛用于污水处理。实验室利用硫酸厂烧渣(主要成分为铁的氧化物及少量FeS、SiO2等)制备聚铁和绿矾(FeSO4·7H2O),过程如下:
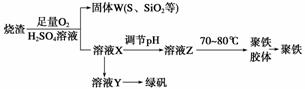
(1)验证固体W焙烧后产生的气体含有SO2的方法是________________。
(2)实验室制备、收集干燥的SO2,所需仪器如下。装置A产生SO2,按气流方向连接各仪器接口,顺序为a→________→________→________→________→f。
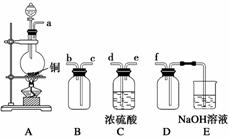 装置A中发生反应的化学方程式为___________________。
装置A中发生反应的化学方程式为___________________。
(3)制备绿矾时,向溶液X中加入过量________,充分反应后,
经过滤操作得到溶液Y,再经浓缩、结晶等步骤得到绿矾。
过滤所需的玻璃仪器有________________。
(4)欲测定溶液Y中Fe2+的浓度,需要用容量瓶配制KMnO4标准
溶液,用KMnO4标准溶液滴定时应选用________滴定管(填
“酸式”或“碱式”)。
(5)溶液Z的pH影响聚铁中铁的质量分数。若溶液Z的pH偏小,将导致聚铁中铁的质量分数________(填“偏大”、“偏小”或“无影响”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com