
【题目】按要求填空:
(1)以下列出的是一些原子的2p能级和3d能级中电子排布的情况.试判断,违反了泡利原理的是 ,违反了洪特规则的是 .
A. |
B. |
C. |
D. |
E.![]()
F.![]()
(2)某元素的激发态(不稳定状态)原子的电子排布式为1s22s22p63s13p33d2,则该元素基态原子的电子排布式为 ;其最高价氧化物对应水化物的化学式是 .
(3)用符号“>”“<”或“=”表示下列各项关系.
①第一电离能:Na Mg,Mg Ca.
②电负性:O F,F Cl.
③能量高低:ns (n+1)s,ns np.
【答案】(1)A;BDE;
(2)1s22s22p63s23p4;H2SO4;
(3)①<;>;
②<;>;
③<;<.
【解析】试题分析:(1)泡利不相容原理:每个原子轨道上最多只能容纳2个自旋状态相反的电子;
洪特规则:在同一个电子亚层中排布的电子,总是尽先占据不同的轨道,且自旋方向相同;
(2)同一元素的原子中,基态和激发态原子的核外电子总数相等,根据构造原理书写其基态原子核外电子排布式;在主族元素中,元素的最高化合价等于其族序数,从而确定其最高价氧化物对应的水化物;
(3)①同一周期中,元素的第一电离能随着原子序数的增大而呈增大趋势,但第IIA族元素大于相邻元素,同一主族元素中,元素的第一电离能随着原子序数的增大而减小;
②同一周期中,元素的电负性随着原子序数的增大而增大,同一主族中,元素的电负性随着原子序数的增大而减小;
③电子的能层越大其能量越高,同一能层的电子,按s、p、d、能量逐渐增大.
解:(1)泡利不相容原理:每个原子轨道上最多只能容纳2个自旋状态相反的电子;
洪特规则是指在同一个电子亚层中排布的电子,总是尽先占据不同的轨道,且自旋方向相同;
所以违反泡利不相容原理的有A,违反洪特规则的有 BDE,
故答案为:A;BDE;
(2)根据激发态原子核外电子排布式知该元素核外有16个电子,根据构造原理知,其基态原子核外电子排布式为:1s22s22p63s23p4,该元素是S元素,S元素最外层有6个电子,其最高化合价是+6价,其最高价氧化物对应的水化物是硫酸,其化学式为H2SO4,
故答案为:1s22s22p63s23p4;H2SO4;
(3)①同一周期中,元素的第一电离能随着原子序数的增大而呈增大趋势,但第IIA族元素大于相邻元素,同一主族元素中,元素的第一电离能随着原子序数的增大而减小,所以第一电离能:Na<Mg,Mg>Ca,
故答案为:<;>;
②同一周期中,元素的电负性随着原子序数的增大而增大,同一主族中,元素的电负性随着原子序数的增大而减小,所以电负性:O<F,F>Cl,
故答案为:<;>;
③电子的能层越大其能量越高,同一能层的电子,按s、p、d、能量逐渐增大,所以能量高低:ns<(n+1)s,ns<np,
故答案为:<;<.


 优质课堂快乐成长系列答案
优质课堂快乐成长系列答案科目:高中化学 来源: 题型:
【题目】用铁片与稀硫酸反应制取氢气时,下列措施不能使氢气生成速率加快的是
A.滴加少量CuSO4溶液
B.不用稀硫酸,改用98%的浓硫酸
C.对该反应体系加热
D.不用铁片,改用铁粉
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某合成路线如下图所示:
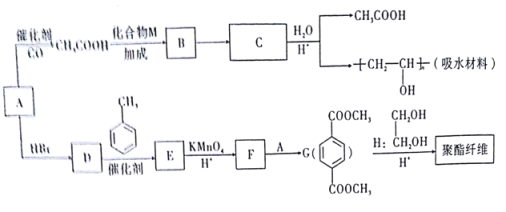
已知:①有机物A能与Na反应,相对分子质量为32
![]()
(1)F的名称是 ,C的结构简式是 。
(2)M的结构式是 ,B→C的反应类型是 。
(3)写出由1,2——二溴乙烷制备物质H的化学方程式 。
(4)G的同分异构体有多种,满足下列条件的共有 种。
①苯环上只有两个取代基 ②1mol与足量的NaHCO3溶液反应生成2molCO2气体
(5)G→聚酯纤维的化学方程式是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室测定碳酸钠和碳酸氢钠混合物中碳酸钠的质量分数ω(Na2CO3),称取此混合物mg,溶于水中,配成溶液。
I.方案一:沉淀法。利用化学反应把HCO3-、CO32-完全转化为沉淀,称量干燥沉淀的质量,由此计算混合物中ω(Na2CO3)。
(1)量取配置好的溶液于烧杯中,滴加足量沉淀剂,把溶液中HCO3-、CO32-完全转化为沉淀,应选用的试剂是 。
(2)若选用(1)的沉淀剂沉淀后,过滤,洗涤沉淀,判断沉淀是否洗净的方法是 。
II.方案二:量气法。如图所示,量取配制好的溶液与足量稀硫酸溶液反应,测定生成气体的体积,由此计算混合物中ω(Na2CO3)。
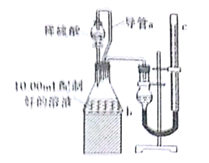
(1)装置中导管a的作用是 。
(2)正确读取气体体积的操作 。
(3)某同学根据方案二的思路提出方案三:把生成的气体通入足量的生石灰,测定增重的质量,由此计算混合物中ω(Na2CO3),若按此方案,则测得的ω(Na2CO3) (填“偏大”“偏小”或“无影响”)。为减小误差,请完善他的方案 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W为四种短周期主族元素,它们在周期表中的位置如右图所示。W元素的简单离子半径在同周期元素的简单离子中最小。下列说法中正确的是 ( )

A. Y元素的气态氢化物易液化,是因为其分子间能形成氢键
B. X元素最高价氧化物分子的比例模型为![]()
C. Z单质与X元素最高价氧化物、Y单质都能反应,体现氧化性
D. W的单质在地壳含量丰富,工业上可通过电解它的无水盐来制备。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 用分液漏斗分离饱和食盐水与醇的混合物
B. 容量瓶用蒸馏水洗涤后必须烘干才能进行溶液的配制
C. 分馏石油时,温度计的水银求必须插入液面以下
D. 氯化钠溶液蒸发结晶时,蒸发皿中有大量晶体析出并剩余少量溶液时即停止加热
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】过氧化氢和臭氧是用途很广的氧化剂。试回答下列问题:
(1)过氧化氢是一种绿色氧化剂,写出在酸性条件下H2O2氧化KI的离子反应方程式:
(2)Na2O2 、K2O2、 以及BaO2都可与酸作用生成过氧化氢,目前实验室制取过氧化氢可通过上述某种过氧化物与适量稀硫酸作用,过滤即可制得。最适合的过氧化物是____________(写电子式),
(3)火箭发射常以液态肼(N2H4)为燃料,液态过氧化氢为助燃剂.
已知:N2H4(g)+O2(g)=N2(g)+2H2O(l) △H=-534kJmol-1
H2O2(l)=H2O(l)+1/2O2(g) △H=-98.64kJmol-1
H2O(l)=H2O(g) △H=+44kJmol-1
则反应N2H4(g)+2H2O2(l)=N2(g)+4H2O(g)的△H=_________
臭氧(O3)可以使湿润的淀粉-碘化钾试纸变蓝,反应的化学方程式为:
KI+O3+H2O→KOH+I2+O2(未配平)回答问题:
①还原产物的化学式为_________
②配平后的化学方程式是__________________

(4)O3 可由臭氧发生器(原理如图所示)电解稀硫酸制得。
①图中阴极为 (填“A”或“B”)。
②若C处不通入O 2 ,D、E处分别收集到11.2L和有4.48L气体(标准状况下), 则E处收集的气体中O3所占的体积分数为 (忽略 O 3 的分解)。
③若C处通入O 2,则A极的电极反应式为: 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关铁、铜及其化合物的说法正确的是
A. 铁和铜在自然界中主要以游离态的形式存在
B. 工业上在高温下用CO还原含Fe2O3的铁矿石炼铁
C. 常温下铁与浓硫酸不反应
D. 用激光照射硫酸铜溶液可观察到丁达尔现象
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】著名化学家徐光宪获得“国家最高科学技术奖”,以表彰他在稀土萃取理论方面作出的贡献。稀土铈(Ce)元素主要存在于独居石中,金属铈在空气中易氧化变暗,受热时燃烧,遇水很快反应。已知:铈常见的化合价为+3和+4,氧化性:Ce4+>Fe3+。下列说法不正确的是( )
A. 铈(Ce)元素在自然界中主要以化合态形式存在
B. 铈溶于氢碘酸的化学方程式可表示为:Ce + 4HI = CeI4 + 2H2↑
C. 用Ce(SO4)2溶液滴定硫酸亚铁溶液,其离子方程式为:Ce4++Fe2+ = Ce3++Fe3+
D. 四种稳定的核素![]() 、
、![]() 、
、![]() 、
、![]() ,它们互称为同位素
,它们互称为同位素
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com