
已知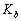 = 1.8 ×10-5,计算 0.10 mol·L-1 的 NH3·H2O 的 ;若向其中加入固体NH4Cl ,使 的浓度达到 0.20 mol·L-1 ,求 。
= 1.8 ×10-5,计算 0.10 mol·L-1 的 NH3·H2O 的 ;若向其中加入固体NH4Cl ,使 的浓度达到 0.20 mol·L-1 ,求 。
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
下列各组物质相互混合反应后,最终有白色沉淀生成的是
①金属钠投入FeCl2溶液中 ②过量NaOH溶液和明矾溶液混合 ③少量Ca(OH)2投入过量NaHCO3溶液中 ④向NaAlO2溶液中通入过量CO2 ⑤向饱和Na2CO3溶液中通入过量CO2
A.①③④⑤ B.①④ C.②③ D.③④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
一定条件下,溶液的酸碱性对TiO2光催化染料R降解反应的影响如图所示。下列判断正确的是( )
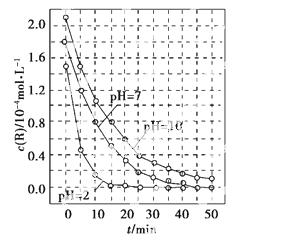
A.在0~50 min之间,pH=2和pH=7时R的降解百分率相等
B.溶液酸性越强,R的降解速率越小
C.R的起始浓度越小,降解速率越大
D.在20~25 min之间,pH=10时R的平均降解速率为0.04 mol·L-1·min-1
查看答案和解析>>
科目:高中化学 来源: 题型:
某密闭容器中充入等物质的量的A和B,一定温度下发生反应A(g)+xB(g)  2C
2C (g),达到平衡后,在不同的时间段,分别改变影响反应的一个条件,测得容器中物质的物质的量浓度、反应速率分别随时间的变化如下图所示:
(g),达到平衡后,在不同的时间段,分别改变影响反应的一个条件,测得容器中物质的物质的量浓度、反应速率分别随时间的变化如下图所示:
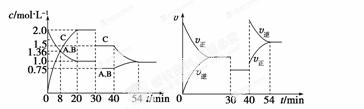
下列说法中正确的是  ( )
( )
A.30~40 min间该反应使用了催化剂
B.反应方程式中的x=1,正反应为吸热反应
C.30 min时降低温度,40 min时升高温度
D.8 min前A的平均反应速率为0.08 mol·L-1·min-1
查看答案和解析>>
科目:高中化学 来源: 题型:
根据酸碱的质子理论,“凡是能给出质子的分子或离子都是酸;凡是能结合质子的分子或离子都是碱。”按这个理论,下列微粒:
①HS-,②CO32-,③HPO42-,④NH3,⑤OH-,⑥H2O,⑦HCO3-,⑧HAc,⑨KHSO4
(1)只属于碱的微粒是: ;
(2)只属于酸的微粒是: ;
(3)属于两性的微粒是: 。(填编号)。
查看答案和解析>>
科目:高中化学 来源: 题型:
二元酸H2A的电离反应如下:
H2A  HA- + H+ K1 = 4.50×10-7 HA-
HA- + H+ K1 = 4.50×10-7 HA- A2- + H+ K2 = 4.70×10-11
A2- + H+ K2 = 4.70×10-11
用0.300 mol·L-1 HCl滴定含有Na2A和NaHA的一份20.00 mL的溶液,滴定进程用玻璃电极pH计跟踪,滴定曲线上的两个点对应的数据如下:
| 加入的HCl/mL | 1.00 | 10.00 |
| pH | 10.33 | 8.34 |
(1)加入1.00 mL HCl时首先与HCl反应的物种是什么?产物是什么?
(2)(1)中生成的产物有多少mmol?
(3)写出(1)中生成的产物与溶剂反应的主要平衡式
(4)起始溶液中存在的Na2A和NaHA的量各有多少mmol?
(5)计算为达到第二个等当点所需要HCl的总体积。
查看答案和解析>>
科目:高中化学 来源: 题型:
图中a、b是惰性电极,通电2 min后b电极附近溶液呈红色,b电极生成标准状况时的气体体积为0.224 L,NaCl溶液体积为500 mL,下列说法不正确的是( )

A.电解过程中 CuSO4溶液物质的量浓度不变
CuSO4溶液物质的量浓度不变
B.电子流动的方向是由a流向Cu电极
C.电路中通过的电子为0.02 mol
D.电解速率v(OH-)=0.02 mol·L-1·min-1
查看答案和解析>>
科目:高中化学 来源: 题型:
短周期金属元素甲~戊在元素周期表中的相对位置如图所示.下列判断正确的是( )

|
| A. | 原子半径:丙<丁<戊 | B. | 金属性:甲>丙 |
|
| C. | 氢氧化物碱性:丙>丁>戊 | D. | 最外层电子数:甲>乙 |
查看答案和解析>>
科目:高中化学 来源: 题型:
短周期主族元素X、Y、Z、W的原子序数依次增大.X原子的最外层电子数是其内层电子数的2倍,Y是地壳中含量最高的元素,Z2+与Y2﹣具有相同的电子层结构,W与X同主族.下列说法正确的是( )
|
| A. | Y的气态简单氢化物的热稳定性比W的强 |
|
| B. | X的最高价氧化物对应水化物的酸性比W的弱 |
|
| C. | Y分别与Z、W形成的化合物均为碱性氧化物 |
|
| D. | 原子半径大小顺序:r(W)>r(Z)>r(Y)>r(X) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com