
【题目】化学与生产、生活、社会密切相关。下列说法中不正确的是
A.蛋白质、棉花、PVC、淀粉都是混合物
B.废弃的玻璃、金属、纸制品是可回收利用的资源
C.铁在潮湿的空气中放置,易发生化学腐蚀而生锈
D.用CO2合成聚碳酸酯可降解塑料,实现“碳”的循环利用
 云南师大附小一线名师提优作业系列答案
云南师大附小一线名师提优作业系列答案 冲刺100分单元优化练考卷系列答案
冲刺100分单元优化练考卷系列答案科目:高中化学 来源: 题型:
【题目】将质量为12.64g KMnO4固体加热一段时间后,收集到amolO2;向反应后残留的固体中加入足量的浓盐酸,又收集到bmolCl2,此时Mn元素全部以Mn2+的形式存在于溶液中。
(1)请完成并配平下列化学方程式:
K2MnO4+ HCl - KCl+ MnCl2+ Cl2↑+________□
该反应中的还原剂是 ,当该反应中转移NA个电子时,氧化产物的物质的量为 mol,被氧化的还原剂的物质的量为 mol。
(2)用酸性高锰酸钾溶液滴定FeSO4溶液写出该反应的离子方程式 。
(3)当KMnO4固体加热生成O2 a mol值最大时,向反应后残留的固体中加入足量的浓盐酸并加热,产生Cl2的物质的量b= mol。(此时Mn元素全部以Mn2+的形式存在于溶液中)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表为4种常见溶液中溶质的质量分数和物质的量浓度:
溶 质 | HCl | NaOH | CH3COOH | HNO3 |
溶质的质量分数/% | 36.5 | 40 | 60 | 63 |
物质的量浓度/mol·L-1 | 11.8 | 14.3 | 10.6 | 13.8 |
这4种溶液中密度最小的是( )
A.HCl B.NaOH C.CH3COOH D.HNO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ、下列物质的转化或分离方法的序号填在横线上(每一项只填写一种方法,用序号填空)。①溶解 ②裂解 ③分馏 ④裂化 ⑤干馏 ⑥蒸馏 ⑦过滤 ⑧电解 ⑨萃取
(1)将海水淡化 。
(2)从海水得到的无水MgC12中提取金属镁 。
Ⅱ、下图所示为某化学兴趣小组设计的乙醇催化氧化及其产物检验的实验装置(图中加热仪器、铁架台、铁夹等均未画出)。
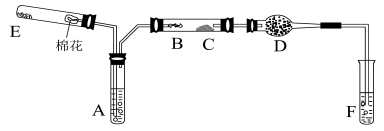
图中:A为无水乙醇(沸点为78℃),
B为绕成螺旋状的细铜丝或银丝,
C为无水CuSO粉末,
D为碱石灰,
F为新制的氢氧化铜悬浊液。
已知: 含—CHO的物质在加热条件下与新制的Cu(OH)2悬浊液反应生成砖红色沉淀.
(1)在上述装置中,实验时需要加热的仪器为(填仪器或某部位的代号) 。
(2)为使A中乙醇平稳气化成乙醇蒸气,常采用的方法是_____________。
D处使用碱石灰的作是 。
(3) E处是一种纯净物,其反应方程式为 。
(4)写出乙醇发生催化氧化的化学方程式 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,用0.1molL-1HCl溶液滴定10.0mL浓度为0.1molL-1Na2CO3溶液,所得滴定曲线如图所示。下列微粒浓度大小关系正确的是
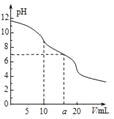
A. 当V=0时:c(H+)+c(HCO3-)+c(H2CO3)=c(OH-)
B. 当V=5时:c(CO32-)+c(HCO3-)+c(H2CO3)=2c(Cl-)
C. 当V=10时:c(Na+)>c(HCO3-)>c(CO32-)>c(H2CO3)
D. 当V=a时:c(Na+)=c(Cl-)>c(H+)=c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物中碳原子和氢原子个数比为3∶4,不能与溴水反应却能使酸性KMnO4溶液褪色。其蒸气密度是相同状况下甲烷密度的7.5倍。在铁存在时与溴反应,能生成两种一溴代物。该有机物可能是
A. CH≡C-CH3
B. ![]()
C. CH2=CHCH3
D. 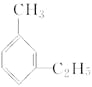
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】苯甲酸广泛应用于制药和化工行业。某同学尝试用甲苯的氧化反应制备苯甲酸。
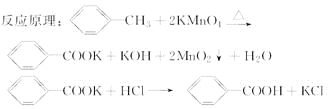
实验方法:一定量的甲苯和KMnO4溶液在100 ℃反应一段时间后停止反应,按如下流程分离出苯甲酸和回收未反应的甲苯。
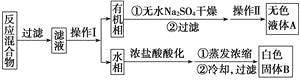
已知:苯甲酸分子量122,熔点122.4 ℃,在25 ℃和95 ℃时溶解度分别为0.3 g和6.9 g;纯净固体有机物一般都有固定熔点。
(1)操作Ⅰ为________,操作Ⅱ为________。
(2)无色液体A是________,定性检验A的试剂是________,现象是________。
(3)测定白色固体B的熔点,发现其在115 ℃开始熔化,达到130 ℃时仍有少量不熔。该同学推测白色固体B是苯甲酸与KCl的混合物,设计了如下方案进行提纯和检验,实验结果表明推测正确。请在完成表中内容。
序号 | 实验方案 | 实验现象 | 结果 |
① | 将白色固体B加入水中,加热溶解,________ | 得到白色晶体和无色滤液 | |
② | 取少量滤液于试管中,________ | 生成白色沉淀 | 滤液含Cl- |
③ | 干燥白色晶体,________ | ________ | 白色晶体是苯甲酸 |
(4)纯度测定:称取1.220 g产品,配成100 mL苯甲酸溶液,移取25.00 mL溶液,滴定,消耗KOH的物质的量为2.40×10-3mol,产品中苯甲酸质量分数的计算结果为________(保留2位有效数字)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A、B、C、D四种元素的原子序数为A<B<C<D,且都小于18。A、B位于同周期,A元素的原子最外层电子数是次外层电子数的2倍,B元素的原子最外层电子数是次外层电子数的3倍。C、D同周期, C元素的原子半径在同周期中最大,D元素的原子最外层电子数比次外层电子数少1个。试推断:
(1)请写出A、B、C、D四种元素的元素符号:A________,B________,C________,D_______。
(2)画出D元素的离子结构示意图_______________。
(3)AB2中存在的化学键是 (离子键、共价键), CD的电子式为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com