


分析 (1)铝片和铜片用导线相连,一组插入浓硝酸中,一组插入烧碱溶液中,分别形成了原电池,根据负极金属单质上电子来判断;碱性条件下,Al失电子生成偏铝酸根离子;
(2)电解制备Al(OH)3时,Al为阳极,阴极生成氢气和氢氧根离子;
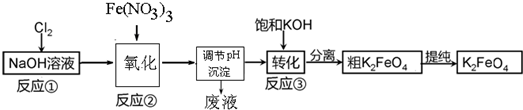
(3)腐蚀废液中含有氯化铜、氯化亚铁,加入过量的铁可以和氯化铜反应生成金属铜和氯化亚铁,故A为Fe,经①所得滤液是氯化亚铁,滤渣是金属铜和过量的铁,铜不能盐酸反应,而金属铁可以,加入过量B为盐酸可以将铜分离,得到的滤液为氯化亚铁,滤液合并后通入氯气,能将亚铁离子氧化为三价铁,以此解答该题.
解答 解:(1)将铝片和铜片用导线相连,一组插入浓硝酸中,铝钝化,所以Cu失电子作负极,一组插入烧碱溶液中,Cu与氢氧化钠不反应,Al失电子作负极,
故答案为:B;
(2)电解制备Al(OH)3时,Al为阳极,阴极生成氢气和氢氧根离子,电解方程式为2Al+6H20 $\frac{\underline{\;通电\;}}{\;}$2Al(OH)3↓+3H2↑,
故答案为:2Al+6H20 $\frac{\underline{\;通电\;}}{\;}$2Al(OH)3↓+3H2↑,
(3)流程①中回收金属铜时,涉及反应为铁与氯化铜的反应,离子方程式为Fe+Cu2+=Fe2++Cu,如将该反应涉及成原电池,则铁为负极,正极可用碳棒,电解质溶液为硫酸铜,装置为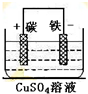 ,
,
故答案为:Fe+Cu2+=Fe2++Cu; .
.
点评 本题考查化学工艺流程、原电池、电解池等,侧重于学生的分析能力以及元素化合物知识的综合理解和运用的考查,注意把握原电池的工作原理,难度不大,掌握元素化合物的性质是关键.


 综合自测系列答案
综合自测系列答案科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2H2 (g)+O2(g)═2H2O(g)△H1; 2H2(g)+O2(g)═2H2O(l)△H2 | |
| B. | S(g)+O2(g)═SO2(g)△H1; S(s)+O2(g)═SO2(g)△H2 | |
| C. | CO(g)+$\frac{1}{2}$ O2(g)═CO2(g)△H1; 2CO(g)+O2(g)═2CO2(g)△H2 | |
| D. | $\frac{1}{2}$ H2(g)+$\frac{1}{2}$ Cl2(g)═HCl(g)△H1;H2(g)+Cl2(g)═2HCl(g)△H2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③④⑤ | B. | ①②⑤ | C. | ②③④⑤ | D. | ①⑥⑦⑧ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 煤经处理变为气体燃料的过程属于物理变化 | |
| B. | 往BaCl2溶液中通入少量CO2有白色沉淀生成 | |
| C. | 医用酒精、冰醋酸、液态HCl都是混合物 | |
| D. | 乙酸乙酯和一氯乙烷在一定条件下均可水解生成乙醇 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向Na[Al(OH)4]溶液中通入过量CO22[Al(OH)4]-+CO2=2Al(OH)3↓+CO32-+H2O | |
| B. | FeO和稀HNO3反应FeO+2H+=Fe2++H2O | |
| C. | (NH4)2Fe(SO4)2溶液与过量NaOH溶液反应制备Fe(OH)2Fe2++NH4++3OH-=Fe(OH)2↓+NH3?H2O | |
| D. | NaHSO4与Ba(OH)2混合至溶液呈中性Ba2++2OH-+2H++SO42-=BaSO4↓+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| a(干燥气体) | b(液体) | 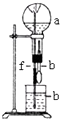 | |
| A | Cl2 | 饱和食盐水 | |
| B | NO+O2(物质的量之比为4:1) | H2O | |
| C | CO2 | NaOH | |
| D | NO2 | H2O |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碱性:KOH>NaOH | B. | 酸性:HClO4>H2SO4 | ||
| C. | 相对原子质量:Ar>K | D. | 元素的金属性:Mg>Al |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙酸具有酸的通性,能使紫色的石蕊溶液变红 | |
| B. | 在一定条件下,苯与液溴、浓硝酸作用生成溴苯、硝基苯的反应都属于取代反应 | |
| C. | 己烷有4种同分异构体,它们的熔点、沸点各不相同 | |
| D. | 用溴水可以鉴别乙烯和乙烷 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com