
【题目】甲是一种可用于净水和膨化食品的盐,由A,B,C,D,E五种短周期元素组成.甲溶于水后可电离出三种离子,其中一种是由A、B形成的10电子阳离子.A元素原子核内质子数比E的少l,D,E同主族.某同学为探究甲的组成而进行如下实验:
①取mg甲的晶体溶于蒸馏水,配成500mL溶液;
②取少量甲溶液于试管中,逐滴滴入Ba(OH)2溶液,生成沉淀的物质的量与滴入Ba(OH)2溶液体积的关系如图所示;
③取20mL甲溶液于试管中,加入过量NaOH溶液后加热并收集产生的气体,然后折算成标准状况下的体积为224mL.
回答下列问题:
(1)D在元素周期表中的位置为 .
(2)经测定晶体甲的摩尔质量为453gmol﹣1 , 其中阳离子和阴离子物质的量之比为1:1. 则晶体甲的化学式为 .
(3)图象中V(Oa):V(ab):V(bc)= 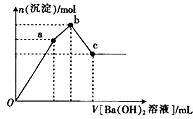
(4)写出ab段发生反应的离子方程式: .
(5)配成的甲溶液物质的量浓度是 .
【答案】
(1)第三周期VIA族
(2)NH4Al(SO4)2?12H2O
(3)3:1:1
(4)2NH4++SO42﹣+Ba2++2OH﹣=BaSO4↓+2NH3 . H2O
(5)0.5mol?L﹣1
【解析】解:甲由A、B、C、D、E五种短周期元素组成的一种盐,②取少量甲溶液于试管中,逐滴滴入Ba(OH)2溶液,生成沉淀开始增大,后沉淀减小,但沉淀最终不完全消失,则甲溶液肯定含有SO42﹣、Al3+ , ③取20mL甲溶液于试管中,加入过量NaOH溶液后加热并收集产生的气体,则甲溶液中含有NH4+ , 甲溶于电离处于三种离子,A、B形成的10电子阳离子为NH4+ , D、E同主族,二者应形成SO42﹣ , 且A元素原子核内质子数比E的少l,则A为N元素、E为O元素、D为S元素、B为H元素、C为Al.(2)中经测定晶体甲的摩尔质量为453g.mol﹣1 , 且1mol甲晶体中含有12mol结晶水,所以阳离子和阴离子的分子量为:453﹣216=237,阳离子和阴离子物质的量之比1:1,根据电中性原理,其化学式为:NH4Al(SO4)212H2O.oa段发生反应:2NH4Al(SO4)2+3Ba(OH)2=3BaSO4↓+2Al(OH)3↓+(NH4)2SO4 , ab段发生反应:(NH4)2SO4+Ba(OH)2=BaSO4↓+2NH3 . H2O,bc段发生反应:OH﹣+Al(OH)3=AlO2﹣+2H2O.(1)D为S元素,处于周期表中第三周期VIA族,
故答案为:第三周期VIA族;(2)由上述分析可知,甲的化学式为:NH4Al(SO4)212H2O,
故答案为:NH4Al(SO4)212H2O;(3)假设NH4Al(SO4)212H2O为2mol,oa段发生反应:2NH4Al(SO4)2+3Ba(OH)2=3BaSO4↓+2Al(OH)3↓+(NH4)2SO4 , 消耗3molBa(OH)2 , 生成1mol(NH4)2SO4 , 生成2molAl(OH)3 , ab段发生反应:(NH4)2SO4+Ba(OH)2=BaSO4↓+2NH3 . H2O,1mol(NH4)2SO4消耗1molBa(OH)2 , bc段发生反应:OH﹣+Al(OH)3=AlO2﹣+2H2O,2molAl(OH)3消耗1molBa(OH)2 , 故图象中V(Oa):V(ab):V(bc)=3mol:1mol:1mol=3:1:1,
故答案为:3:1:1;(4)ab段发生反应:(NH4)2SO4+Ba(OH)2=BaSO4↓+2NH3 . H2O,离子方程式为:2NH4++SO42﹣+Ba2++2OH﹣=BaSO4↓+2NH3 . H2O,
故答案为:2NH4++SO42﹣+Ba2++2OH﹣=BaSO4↓+2NH3 . H2O;(5)实验③中取20mL甲溶液于试管中,加入过量NaOH溶液后加热并收集产生的氨气为 ![]() =0.01mol,则NH4Al(SO4)2为0.01mol,故溶液浓度为
=0.01mol,则NH4Al(SO4)2为0.01mol,故溶液浓度为 ![]() =0.5mol/L,
=0.5mol/L,
故答案为:0.5mol/L.
甲由A、B、C、D、E五种短周期元素组成的一种盐,②取少量甲溶液于试管中,逐滴滴入Ba(OH)2溶液,生成沉淀开始增大,后沉淀减小,但沉淀最终不完全消失,则甲溶液肯定含有SO42﹣、Al3+ , ③取20mL甲溶液于试管中,加入过量NaOH溶液后加热并收集产生的气体,则甲溶液中含有NH4+ , 甲溶于电离处于三种离子,A、B形成的10电子阳离子为NH4+ , D、E同主族,二者应形成SO42﹣ , 且A元素原子核内质子数比E的少l,则A为N元素、E为O元素、D为S元素、B为H元素、C为Al.(2)中经测定晶体甲的摩尔质量为453g.mol﹣1 , 且1mol甲晶体中含有12mol结晶水,所以阳离子和阴离子的分子量为:453﹣216=237,阳离子和阴离子物质的量之比1:1,根据电中性原理,其化学式为:NH4Al(SO4)212H2O,oa段发生反应:2NH4Al(SO4)2+3Ba(OH)2=3BaSO4↓+2Al(OH)3↓+(NH4)2SO4 , ab段发生反应:(NH4)2SO4+Ba(OH)2=BaSO4↓+2NH3 . H2O,bc段发生反应:OH﹣+Al(OH)3=AlO2﹣+2H2O,据此解答.


 一线名师提优试卷系列答案
一线名师提优试卷系列答案科目:高中化学 来源: 题型:
【题目】硫酰氯(SO2Cl2)是一种重要的化工试剂,实验室合成硫酰氯的实验装置如下图所示: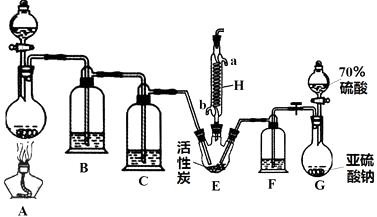
已知:① SO2(g)+Cl2(g) ![]() SO2Cl2(l) ΔH=-97kJ/mol;
SO2Cl2(l) ΔH=-97kJ/mol;
② 硫酰氯常温下为无色液体,熔点为-54.1℃,沸点为69.1℃,在潮湿空气中“发烟”;
③ 100℃以上或长时间存放硫酰氯都易分解,生成二氧化硫和氯气。
回答下列问题:
(1)硫酰氯在潮湿空气中“发烟”的原因是(用化学方程式表示)。
(2)检验装置G气密性的方法是。
(3)装置A中发生反应的离子方程式为。
(4)H的作用是 , 其中水流的方向是→(填a或b)。
(5)装置C、F中的试剂相同,盛放的试剂为。
(6)该装置存在的一处缺陷是。
(7)若将SO2、Cl2按照一定比例通入水中,请设计简单实验验证二者是否恰好完全反应(简要描述实验步骤、现象和结论):
。仪器自选;供选择试剂:滴加酚酞的氢氧化钠溶液、氯化亚铁溶液、硫氰化钾溶液、品红溶液。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下图所给信息,得出的结论正确的是( ) 
A.碳的燃烧热为b kJ/mol
B.2C(s)+O2(g)═2CO(g)△H=﹣2(b﹣a) kJ/mol
C.2CO2(s)═2CO(g)+O2(g)△H=+a kJ/mol
D.C(s)+O2(g)═CO2(g)△H<﹣b kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的数值,则下列说法中正确的是( )
A.80g硝酸铵含有氮原子数为2NA
B.标准状况下,22.4L CCl4所含分子数目为NA
C.常温常压下,32 g的O2和O3混合气体含有的原子数为2NA
D.8.4gNaHCO3溶解于水,电离生成的CO ![]() 数目为0.1NA
数目为0.1NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列水解反应的离子方程式书写正确的是( )
A.CO32﹣+2H2OH2CO3+2OH﹣
B.NH4++H2ONH3H2O+H+
C.Al3++3H2OAl(OH)3↓+H2O
D.HCO3﹣+H2OH3O++CO32﹣
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】天然维生素P(结构如图)存在于槐树花蕾中,它是一种营养增补剂.关于维生素P的叙述正确的是( ) 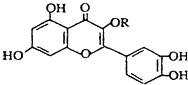
A.若R为甲基则该物质的分子式可以表示为C16H10O7
B.分子中有三个苯环
C.lmol该化合物与NaOH溶液作用消耗NaOH的物质的量以及与氢气加成所需的氢气的物质的量分别是4 mol、8 mol
D.lmol该化合物最多可与7molBr2完全反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据所学知识,完成下面题目:
(1)同温、同压下等质量的SO3和NO2 , 它们所占的体积比为 , 所含氧元素的物质的量之比为 .
(2)2molO2与1molO3的摩尔质量的比是 .
(3)某化合物的相对分子质量为m,在t℃时A ml该化合物的饱和溶液为B g,将其蒸干后得到固体C g.该化合物在t℃时的溶解度为g,该饱和溶液中溶质的物质的量浓度为mol/L.
(4)实验室制取氯气的化学方程式为:4HCl(浓)+MnO2 ![]() Cl2↑+MnCl2+2H2O, 请回答:MnO2与被氧化的HCl的物质的量之比是;用单线桥法标出电子转移的方向和数目: .
Cl2↑+MnCl2+2H2O, 请回答:MnO2与被氧化的HCl的物质的量之比是;用单线桥法标出电子转移的方向和数目: .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各反应,能用同一离子方程式表示的是( )
A.氢氧化铜与盐酸; 氢氧化铜与醋酸
B.氯化钡溶液与硫酸铜溶液; 氢氧化钡溶液与硫酸铜溶液
C.碳酸氢钠溶液与稀硫酸 碳酸钠溶液与稀硫酸
D.石灰石与稀硝酸 石灰石与稀盐酸
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com