
短周期元素W、X、Y、Z的原子序数依次增大。金属W是制备手机电池的常用材料,X原子的最外层电子数是内层电子数的2倍,元素Y是地壳中含量最高的金属元素,Z原子的最外层电子数是它的电子层数的2倍。下列说法正确的是
A.W的金属性是同主族元素中最强的
B.X、Z形成的化合物为离子化合物
C.X最高价氧化物对应水化物的酸性大于Z的最高价氧化物对应水化物的酸性
D.原子半径Y>Z,离子半径Y3+< Z 2-
D
【解析】
试题分析:短周期元素W、X、Y、Z的原子序数依次增大。金属W是制备手机电池的常用材料,故W为Li;X原子的最外层电子数是内层电子数的2倍,X元素为C;元素Y是地壳中含量最高的金属元素,Y为Al元素;Z原子的最外层电子数是它的电子层数的2倍,Z为S元素;在元素周期表中同族元素随着核电荷数增大,金属性逐渐增强,故Li为碱金属,且金属性为同族中最弱的,A项错误;X、Z形成的化合物为CS2,为共价化合物,故B项错误;X最高价氧化物对应水化物为H2CO3,Z的最高价氧化物对应水化物为H2SO4,非金属性C<S,故酸性H2CO3< H2SO4,故C项错误;Al、S两原子电子层数相同、核电荷数S>Al,故原子半径Al>S,S2-、Al3+电子层数:S2-> Al3+,故离子半径:Y3+< Z 2-,D项正确;本题选D。
考点:无机推断。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源:2014-2015学年浙江省高三第一次五校联考化学试卷(解析版) 题型:选择题
在甲、乙、丙三个不同密闭容器中按不同方式投料,一定条件下发生反应(起始温度和起始体积相同):N2(g)+3H2(g) 2NH3(g) ΔH<0,相关数据如下表所示:
2NH3(g) ΔH<0,相关数据如下表所示:
容器 | 甲 | 乙 | 丙 |
相关条件 | 恒温恒容 | 绝热恒容 | 恒温恒压 |
反应物投料 | 1mol N2、3mol H2 | 2mol NH3 | 2mol NH3 |
平衡时容器体积 | V甲 | V乙 | V丙 |
反应的平衡常数K= | K甲 | K乙 | K丙 |
平衡时NH3的浓度/mol·L-1 | c甲 | c乙 | c丙 |
平衡时NH3的反应速率/mol·L-1·min-1 | v甲 | v乙 | v丙 |
下列说法正确的是
A.V甲>V丙 B.K乙<K丙 C.c乙>c甲 D.v甲=v丙
查看答案和解析>>
科目:高中化学 来源:2014-2015学年山东省高三上学期期末考试化学试卷(解析版) 题型:填空题
(12分)空气质量与我们的健康息息相关,目前我国通过监测6项污染物的质量浓度来计算空气质量指数(AQI),SO2、NO2和CO是其中3项中的污染物。
(1)人们曾经使用铅室法生产硫酸,其主要反应为:SO2(g)+NO2(g) SO3(g)+NO(g)
SO3(g)+NO(g)
①若已知2SO2(g)+O2(g) 2SO3(g) ΔH=a kJ·mol-1
2SO3(g) ΔH=a kJ·mol-1
2NO(g)+O2(g) 2NO2(g) ΔH=b kJ·mol-1
2NO2(g) ΔH=b kJ·mol-1
则SO2(g)+NO2(g) SO3(g)+NO(g) ΔH= kJ·mol-1。
SO3(g)+NO(g) ΔH= kJ·mol-1。
②一定温度下,向固定体积为2 L的密闭容器中充入SO2和NO2各1 mol,发生如下反应:SO2(g)+NO2(g) SO3(g)+NO(g)。下列事实中不能说明该反应达到平衡状态的是 (选填序号)。
SO3(g)+NO(g)。下列事实中不能说明该反应达到平衡状态的是 (选填序号)。
a.体系压强保持不变
b.混合气体的颜色保持不变
c.NO的物质的量保持不变
d.每生成1 mol SO3的同时消耗1 mol NO2
③测得②中反应5 min末到达平衡,此时容器中NO与NO2的体积比为3:1,则这段时间内SO2的反应速率υ(SO2)= ,此反应在该温度下的平衡常数K= 。
(2)甲醇日趋成为重要的有机燃料,通常利用CO和H2合成甲醇,其反应的化学方程式为CO(g)+2H2(g) CH3OH(g)。今在一容积可变的密闭容器中,充有10 mol CO和20 mol H2,用于合成甲醇。CO的平衡转化率(α)与温度(T)、压强(P)的关系如图所示:
CH3OH(g)。今在一容积可变的密闭容器中,充有10 mol CO和20 mol H2,用于合成甲醇。CO的平衡转化率(α)与温度(T)、压强(P)的关系如图所示:
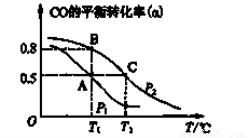
①上述合成甲醇的反应为 反应(填“放热”或“吸热”)。
②A、B、C三点的平衡常数KA、KB、KC的大小关系为 。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年山东省高三上学期期末考试化学试卷(解析版) 题型:选择题
化学与生产、生活、环境密切相关。下列说法不正确的是
A.航天飞机上的隔热陶瓷瓦属于复合材料
B.硫酸钠溶液和氯化钡溶液均能使蛋白质变性
C.“光化学烟雾”、“硝酸型酸雨”的形成都与氮氧化物有关
D.绿色化学的核心是利用化学原理从源头上减少或消除工业生产对环境的污染
查看答案和解析>>
科目:高中化学 来源:2014-2015学年江西省新余市高三上学期期末考试理综化学试卷(解析版) 题型:选择题
常温下,下列溶液的pH或微粒的物质的量浓度关系正确的是
A.某溶液中由水电离出的c(OH-) = 1×10-amol·L-1,若a>7时,则该溶液的pH一定为14-a
B.等体积、等物质的量浓度的Na2SO3溶液与NaHSO3溶液混合:c(Na+) = c(SO32-) + c(HSO3-) + c(H2SO3)
C.将0.2mol·L-1的某一元酸HA溶液和0.1mol·L-1的NaOH溶液等体积混合后溶液的pH大于7,则反应后的混合液:2c(OH-)+c(A-)=2c(H+)+c(HA)
D.pH=3的二元弱酸H2R溶液与pH=11的NaOH溶液混合后,混合液的pH等于7,则反应后的混合液:c(Na+)>2c(R2-)+c(HR-)
查看答案和解析>>
科目:高中化学 来源:2014-2015学年江苏省南通市高三第一次模拟化学试卷(解析版) 题型:填空题
(12分)钴及其化合物广泛应用于磁性材料、电池材料及超硬材料等领域。
(1)CoxNi(1-x)Fe2O4(其中Co、Ni均为+2)可用作H2O2分解的催化剂,具有较高的活性。
①该催化剂中铁元素的化合价为 。
②图1表示两种不同方法制得的催化剂CoxNi(1-x)Fe2O4在10℃时催化分解6%的H2O2溶液的相对初始速率随x变化曲线。由图中信息可知: 法制取得到的催化剂活性更高;Co2+、Ni2+两种离子中催化效果更好的是 。
(2)草酸钴是制备钴的氧化物的重要原料。下图2为二水合草酸钴(CoC2O4·2H2O)在空气中受热的质量变化曲线,曲线中300℃及以上所得固体均为钴氧化物。
①通过计算确定C点剩余固体的化学成分为 (填化学式)。试写出B点对应的物质与O2在225℃~300℃发生反应的化学方程式: 。
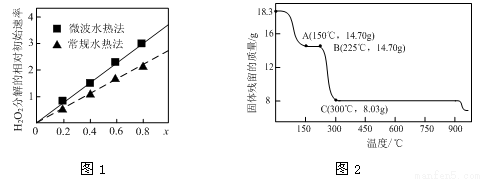
②取一定质量的二水合草酸钴分解后的钴氧化物(其中Co的化合价为+2、+3),用480 mL 5 mol/L盐酸恰好完全溶解固体,得到CoCl2溶液和4.48 L(标准状况)黄绿色气体。试确定该钴氧化物中Co、O的物质的量之比。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年江苏省南通市高三第一次模拟化学试卷(解析版) 题型:选择题
下列有关说法正确的是
A.马口铁(镀锡铁皮)镀层破损后铁仍不易腐蚀
B.CH3Cl(g)+Cl2(g)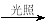 CH2Cl2(l)+HCl(g)能自发进行,则该反应的ΔH>0
CH2Cl2(l)+HCl(g)能自发进行,则该反应的ΔH>0
C.MnS悬浊液中滴加少量CuSO4溶液可生成CuS沉淀,则Ksp(CuS)< Ksp(MnS)
D.合成氨生产中将NH3液化分离,一定能加快正反应速率,提高H2的转化率
查看答案和解析>>
科目:高中化学 来源:2014-2015学年湖北省枣阳市高三上学期期末考试理综化学试卷(解析版) 题型:选择题
下列说法正确的是

A.图I所示装置用于Cu和浓H2SO4制取少量的SO2气体
B.图Ⅱ装置可验证非金属性:Cl>C>Si
C.图Ⅲ可用于收集气体H2、CO2、Cl2、NH3
D.图Ⅳ表示将SO2气体通入溴水中,所得溶液的pH变化
查看答案和解析>>
科目:高中化学 来源:2014-2015学年福建省龙岩市一级达标校高三上学期期末化学试卷(解析版) 题型:实验题
(13分)某兴趣小组利用下列实验装置进行探究实验。
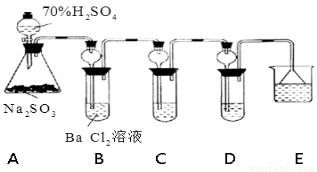
根据要求回答下列问题:
(1)装置中长颈漏斗的作用有导气、 。
(2)利用装置C可以证明SO2具有漂白性,C中盛放的溶液是 ;若要证明其漂白作用是可逆的,还需要的操作是 。
(3)通过观察D中现象,即可证明SO2具有氧化性,D中盛放的溶液可以是 。
a.NaCl溶液 b.酸性KMnO4 c.FeCl3 d.Na2S溶液
(4)研究小组发现B中有白色沉淀生成,若往B中加入过量稀盐酸,沉淀不溶解。沉淀物的化学式是_________。
(5)为进一步验证B中产生沉淀的原因,研究小组进行如下两次实验:
实验i:另取BaCl2溶液,加热煮沸,冷却后加入少量苯(起液封作用),然后再按照上述装置进行实验,结果发现B中沉淀量减少,但仍有轻微浑浊。
实验ii:用下图F装置代替上述实验中的A装置(其他装置不变),

连接后往装置F中通入气体X一段时间,再加入70%H2SO4溶液,结果B中没有出现浑浊。
①“实验i”中煮沸BaCl2溶液的目的是 ;
②气体X不可以是________(填序号)。
a.CO2 b.O3 c.N2 d.NO2
③B中形成沉淀的原因是(用化学方程式表示): 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com