
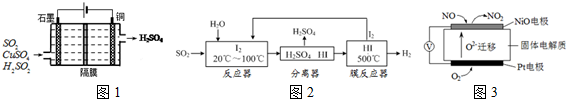
·ÖĪö £Ø1£©¢Ł¶žŃõ»ÆĮņŹĒŅ»ÖÖÓŠ¶¾µÄĘųĢ壬Åŷŵ½æÕĘųÖŠæÉŅżĘšĖįÓźµÄ·¢Éś£¬¶Ō»·¾³ŗĶČĖĄą½”æµÓŠŗ¦£¬ĶŃĮņæÉŅŌ·ĄÖ¹ĖįÓźµÄ·¢Éś£»
ŅĄ¾Ż¶žŃõ»ÆĮņŗĶŃõĘų·“Ó¦·½³ĢŹ½£¬ÕŅ³ö¶žŃõ»ÆĮņŗĶŃõĘųĮæµÄ¹ŲĻµ£»
¢ŚĄūÓƵē½āŌĄķ½«¶žŃõ»ÆĮņ×Ŗ»Æ³ÉĮņĖįĪüŹÕ£¬ĻČŠ“³öĮ½øöµē¼«ÉĻÉĻ·¢ÉśµÄµē¼«·“Ó¦Ź½£¬¼ÓŗĶ¾ĶæɵƵ½×ܵĥė×Ó·½³ĢŹ½£®
£Ø2£©¢Ł“ÓĮ÷³ĢĶ¼æÉÖŖ£¬ŌŚ·“Ó¦Ę÷ÖŠ£¬I2Ńõ»ÆSO2£¬Éś³ÉĮņĖįŗĶHI£»
¢ŚHI·Ö½āŹĒæÉÄę·“Ó¦£¬·ÖĄė³öĒāĘųÓŠĄūÓŚĘ½ŗāÕżĻņŅĘ¶Æ£®
¢ņ£®ÓÉĄė×ӵĶØĻņŅʶÆæÉÖŖNiO¼«ĪŖŌµē³ŲµÄøŗ¼«£¬Pt¼«ĪŖŌµē³ŲµÄÕż¼«£¬Õż¼«·¢Éś»¹Ō·“Ó¦£¬øŗ¼«·¢ÉśŃõ»Æ·“Ó¦£¬ŅŌ“Ė½ā“šøĆĢā£®
½ā“š ½ā£»£Ø2£©¢ŁĶŃĮņæÉŅŌ¼õÉŁ¶žŃõ»ÆĮņµÄÅÅ·ÅĮ棬·ĄÖ¹ĖįÓźµÄ·¢Éś£¬2SO2 +O2 =2SO3
2mol 32g
¹Ź“š°øĪŖ£ŗ·ĄÖ¹ĖįÓźµÄ·¢Éś£»32£»
¢Ś·ÖĪöĶ¼ÖŠµē½ā×°ÖĆ£¬æÉÖŖ×ó±ßŹÆÄ«ŹĒµē½ā³ŲµÄŃō¼«£¬ÓŅ±ßŹĒµē½ā³ŲµÄŅõ¼«£»
Ńō¼«·ÅµēµÄĪļÖŹ¶žŃõ»ÆĮņ£¬Ź§Č„µē×ÓÉś³ÉĮņĖįøłĄė×Ó£¬µē¼«·“Ó¦Ź½£ŗSO2-2e-+2H2O=SO42-+2H+£»
Ņõ¼«·ÅµēµÄĪļÖŹŹ±ĶĄė×Ó£¬µĆµ½µē×Ó±»»¹Ō³Éµ„ÖŹĶ£¬µē¼«·“Ó¦Ź½£ŗCu2++2e-=Cu£»
½«ÉĻŹöĮ½µē¼«µÄµē¼«·“Ó¦Ź½µĆ£ŗSO2+2H2O+Cu2+$\frac{\underline{\;Ķصē\;}}{\;}$4H++SO42-+Cu£¬
¹Ź“š°øĪŖ£ŗSO2+2H2O+Cu2+$\frac{\underline{\;Ķصē\;}}{\;}$4H++SO42-+Cu£®
£Ø2£©¢Ł“ÓĮ÷³ĢĶ¼æÉÖŖ£¬ŌŚ·“Ó¦Ę÷ÖŠ£¬I2Ńõ»ÆSO2£¬Éś³ÉĮņĖįŗĶHI£¬·“Ó¦·½³ĢŹ½ĪŖSO2+I2+2H2O=SO42-+2I-+4H+£¬¹Ź“š°øĪŖ£ŗSO2+I2+2H2O=SO42-+2I-+4H+£»
¢ŚHI·Ö½āĪŖæÉÄę·“Ó¦£¬¼°Ź±·ÖĄė³ö²śĪļH2£¬ÓŠĄūÓŚ·“Ó¦ÕżĻņ½ųŠŠ£¬¹Ź“š°øĪŖ£ŗHI·Ö½āĪŖæÉÄę·“Ó¦£¬¼°Ź±·ÖĄė³ö²śĪļH2£¬ÓŠĄūÓŚ·“Ó¦ÕżĻņ½ųŠŠ£®
¢ņ£®ÓÉĄė×ӵĶØĻņŅʶÆæÉÖŖNiO¼«ĪŖŌµē³ŲµÄøŗ¼«£¬øŗ¼«·“Ó¦ĪŖNO-2e-+O2-=NO2£¬ptµē¼«ÉĻµē¼«·“Ó¦ĪŖO2+4e-=2O2-£¬Ōņµē³ŲÖŠĆæ×ŖŅĘ0.4mol e-£¬Ptµē¼«ĻūŗÄŃõĘųĪŖ0.1mol”Į22.4L/mol=2.24L£¬¹Ź“š°øĪŖ£ŗ2.24£»NO-2e-+O2-=NO2£®
µćĘĄ ±¾Ģāæ¼²éŃõ»Æ»¹Ō·“Ó¦¼°µē»ÆѧÖŖŹ¶£¬ĪŖøßæ¼³£¼ūĢāŠĶŗĶøßĘµæ¼µć£¬×¢Ņā°ŃĪÕŌµē³ŲµÄ¹¤×÷ŌĄķ£¬±¾Ģā½ā“šµÄ¹Ų¼üŹĒĄė×ӵĶØĻņŅĘ¶Æ£¬ŅŌ“ĖæÉČ·¶ØµēŌ“µÄĮ½¼«ŗĶ·“Ó¦ĄąŠĶ£¬×¢ŅāĢå»į“šĢāĖ¼Ā·£¬ĢāÄæÄѶČÖŠµČ£®



| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | Ķ¬Ņ»·“Ó¦ÖŠ£¬Ńõ»Æ¼ĮŹ§µē×ÓµÄ×ÜŹżŅ»¶ØµČÓŚ»¹Ō¼ĮµĆµē×ÓµÄ×ÜŹż | |
| B£® | Ńõ»Æ¼ĮŌŚ·“Ó¦ÖŠ±»»¹Ō£¬Éś³ÉŃõ»Æ²śĪļ | |
| C£® | Ńõ»Æ»¹Ō·“Ó¦µÄĢŲÕ÷ŹĒÓŠ»ÆŗĻ¼ŪµÄÉż½µ | |
| D£® | ČĪŗĪ·“Ó¦ÖŠŅ»¶ØÓŠŃõ»Æ¼ĮŗĶ»¹Ō¼Į£¬ĒŅŃõ»Æ¼ĮŗĶ»¹Ō¼Į±ŲŠėĪŖ²»Ķ¬ÖÖĪļÖŹ |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
| ŹµŃéŠņŗÅ | ¼× | ŅŅ | ±ū |
| ŃĪĖįĢå»ż/mL | 300 | 300 | 300 |
| ŗĻ½šÖŹĮæ/g | 5.1 | 7.65 | 9.18 |
| Éś³ÉĘųĢåĢå»ż/L | 5.6 | 6.72 | 6.72 |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | 4g D2ŗĶ×ćĮæO2·“Ó¦æÉÉś³ÉD2OµÄ·Ö×ÓŹżÄæĪŖ2NA | |
| B£® | 0.1molCl2Óė×ćĮæNaOHČÜŅŗ·“Ó¦£¬×ŖŅʵē×ӵďżÄæĪŖ0.2NA | |
| C£® | ŌŚ±ź×¼×“æöĻĀ£¬2.24L°±ĘųĖłŗ¬µÄµē×Ó×ÜŹżĪŖNA | |
| D£® | ±ź×¼×“æöĻĀ£¬6.4 gŃõĘųŗĶ³ōŃõÖŠŗ¬ÓŠµÄ·Ö×Ó×ÜŹżĪŖ0.2 NA |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ¶ąŃ”Ģā
| A£® | Ģå»żÖ®±ČĪŖ2£ŗ1 | B£® | Ō×Ó×ÜŹżÖ®±ČĪŖ1£ŗ2 | ||
| C£® | ĪļÖŹµÄĮæÖ®±ČĪŖ1£ŗ1 | D£® | ŃõŌ×ÓµÄøöŹżÖ®±ČĪŖ1£ŗ1 |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | Na2CO3ČÜŅŗ | B£® | äåĖ® | C£® | ŠĀÖĘCu£ØOH£©2 | D£® | ø£¶ūĀķĮÖ |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com