

 | 相对分子质量 | 密度/g?cm-3[来源:.Com] | 沸点 | 水中溶解性 | |
| 乙酸 | 60 | 1.051 | 118.0 | 溶 | |
| 环己醇 | 100 | 0.982 | 160.8 | 微溶 | |
| 乙酸环己酯 | 142 | 0.969 | 173.5 | 难溶 |
| 实际产量 |
| 理论产量 |
| 实际产量 |
| 理论产量 |
| 6.9g |
| 14.2g |


 同步练习河南大学出版社系列答案
同步练习河南大学出版社系列答案 同步练习西南师范大学出版社系列答案
同步练习西南师范大学出版社系列答案 补充习题江苏系列答案
补充习题江苏系列答案 学练快车道口算心算速算天天练系列答案
学练快车道口算心算速算天天练系列答案科目:高中化学 来源: 题型:
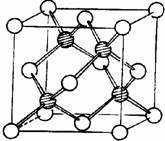 冰晶胞中水分子的空间排列方式与金刚石晶胞(其晶胞结构如图,其中空心球所示原子位于立方体的顶点或面心,实心球所示原子位于立方体内)类似.每个冰晶胞平均占有
冰晶胞中水分子的空间排列方式与金刚石晶胞(其晶胞结构如图,其中空心球所示原子位于立方体的顶点或面心,实心球所示原子位于立方体内)类似.每个冰晶胞平均占有查看答案和解析>>
科目:高中化学 来源: 题型:
| A、HA是弱酸 |
| B、若升高温度,溶液的PH增大 |
| C、此酸的电离平衡常数约为10-5 |
| D、由HA电离出的c(H+)约为水电离出的c(H+)的108倍 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、乙烷和溴蒸气在光照下发生反应 |
| B、将乙烯通入溴水中发生反应 |
| C、乙烯与溴化氢在一定条件下反应 |
| D、乙炔与溴化氢在一定条件下反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
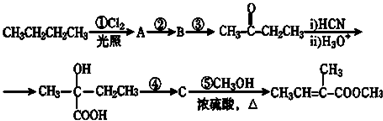
| H3O+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、铊元素的原子半径大于铝元素的原子半径 |
| B、铊单质的固体硬度较小 |
| C、铊的最高氧化物对应的水化物为Tl(OH)3 |
| D、铊及其化合物都没有毒性 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com