
| A. | 单质的沸点:Y>Z | |
| B. | X、Y、Z三种元素不可能形成离子化合物 | |
| C. | X的最高价氧化物对应的水化物的酸性比W的强 | |
| D. | Y分别与Z、W形成的化合物中化学键类型相同 |
分析 短周期主族元素X、Y、Z、W的原子序数依次增大,X原子的最外层电子数是其内层电子数的2倍,由于X的原子序数最小,则X原子只能有2个电子层,最外层电子数为4,则X为碳元素;Y是地壳中含量最高的元素,则Y为O元素,Z2+与Y2-具有相同的电子层结构,Y2-离子核外电子数为10,则Z的质子数为12,则Z为Mg;X、Y、Z、W原子的最外层电子数之和为16,则W的最外层电子数=16-4-6-2=4,W的原子序数最大,则W为Si,据此进行解答.
解答 解:短周期主族元素X、Y、Z、W的原子序数依次增大,X原子的最外层电子数是其内层电子数的2倍,由于X的原子序数最小,则X原子只能有2个电子层,最外层电子数为4,则X为碳元素;Y是地壳中含量最高的元素,则Y为O元素,Z2+与Y2-具有相同的电子层结构,Y2-离子核外电子数为10,则Z的质子数为12,则Z为Mg;X、Y、Z、W原子的最外层电子数之和为16,则W的最外层电子数=16-4-6-2=4,W的原子序数最大,则W为Si,
A.Y为O,Z为Mg,氧气的沸点小于Mg,即Y<Z,故A错误;
B.X、Y、Z分别为C、O、Mg,三种可以形成离子化合物碳酸镁,故B错误;
C.元素的非金属性越强,其最高价氧化物的水化物酸性越强,非金属性X(C)>W(Si),所以X的最高价氧化物对应水化物的酸性比W的强,故C正确;
D.Y和Z、W形成的化合物为MgO、SiO2,MgO、SiO2中存在的化学键分别是离子键、共价键,故B错误;
故选C.
点评 本题考查了原子结构与元素周期律的关系,题目难度中等,正确推断元素为解答关键,注意熟练掌握原子结构与元素周期律、元素周期表的关系,试题培养了学生的灵活应用能力.


 津桥教育计算小状元系列答案
津桥教育计算小状元系列答案科目:高中化学 来源: 题型:选择题
| A. | 1:3:4 | B. | 1:3:1 | C. | 7:5:9 | D. | 7:5:8 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 单位时间内生成3n molB,同时消耗4n molC | |
| B. | 容器内压强不随时间变化 | |
| C. | 混合气体的密度不随时间变化 | |
| D. | B物质的百分含量不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na原子最外层有1个电子,易失去,是活泼的金属元素 | |
| B. | Na原子失去1个电子,Al原子能失去3个电子,说明Na的还原性比Al弱 | |
| C. | Na与氧气反应,在不同的条件下生成不同的产物 | |
| D. | Na在空气中会发生变化,要保存在煤油中,以隔绝空气 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 物质的粒子数可用摩尔这一物理量来计量 | |
| B. | 阿伏加德罗常数个粒子的质量(g)与该粒子的摩尔质量(g/mol)在数值上相等 | |
| C. | 1 L氧气与1L二氧化碳气体含有相同数目的分子 | |
| D. | 40gNaOH溶于1L水,配得1 mol/LNaOH溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | a | b | c | 试管②中现象 | 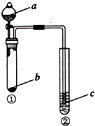 |
| A | NaOH溶液 | 铝 | 肥皂水 | 肥皂泡可点燃 | |
| B | 浓硫酸 | Na2SO3 | Na2SiO3溶液 | 生成白色胶状沉淀 | |
| C | 浓硫酸 | 铜 | 品红溶液 | 溶液红色褪去 | |
| D | 水 | Na2O2 | 酸化的KI溶液 | 溶液变黄 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 12.4g Na2R含Na+0.4mol,则Na2R的摩尔质量为62 g/mol | |
| B. | 同温、同压、同体积的H2和A2气体的质量分别是0.2g和3.2g,则A的相对原子质量为16 | |
| C. | 在标准状况下,CO和CO2混合气体共33.6 L,质量为50g,则两种气体的物质的量之比为1:1 | |
| D. | 浓盐酸的质量分数为36.5%,密度为1.19g•cm-3,则物质的量浓度是11.9 mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 Cl2是一种重要的化工原料,结合氯气的相关知识解决下列问题.
Cl2是一种重要的化工原料,结合氯气的相关知识解决下列问题.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com