
【题目】等物质的量的X(g)与Y(g)在密闭容器中进行可逆反应:X(g)+Y(g)![]() 2Z(g)+W(s) ΔH<0,下列叙述正确的是( )
2Z(g)+W(s) ΔH<0,下列叙述正确的是( )
A.达到平衡时,X、Y的平衡转化率不同
B.升高温度,平衡常数K值增大
C.平衡常数K值越大,X的转化率越大
D.达到平衡时,反应速率v正(X)=2v逆(Z)
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】某原电池构造如图所示,下列叙述正确的是( )

A. 在外电路中,电子由银电极流向铜电极
B. 取出盐桥后,电流表的指针仍发生偏转
C. 外电路中每通过0.1 mol电子,铜的质量理论上减小6.4 g
D. 原电池的总反应式为Cu+2AgNO3===2Ag+Cu(NO3)2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下列各组离子一定能在指定溶液中大量共存的是( )
A.pH=l的溶液中:Ba2+、Fe3+、Cl-、SCN-
B.能使酚酞变红的溶液:Ca2+、K+、HCO3-、CO32-
C.![]() =10-12的溶液中:NH4+、Cu2+、NO3-、SO42-
=10-12的溶液中:NH4+、Cu2+、NO3-、SO42-
D.由水电离的c(H+)=10-12mol·L-1的溶液中:Na+、Al3+、Cl-、NO3-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】过氧化氢是重要的氧化剂、还原剂,它的水溶液又称为双氧水,常用作消毒、杀菌、漂白等。某化学兴趣小组取一定量的过氧化氢溶液,准确测定了过氧化氢的含量。请填写下列空白:
(1)移取10.00mL密度为ρg/mL的过氧化氢溶液至250mL容量瓶中,加水稀释至刻度,摇匀。移取稀释后的过氧化氢溶液25.00mL至锥形瓶中,加入稀硫酸酸化,用蒸馏水稀释,作被测试样。
(2)用高锰酸钾标准溶液滴定被测试样,其反应的离子方程式如下。2MnO4-+5H2O2+6H+=2Mn2++8H2O+5O2↑
(3)滴定时,将高锰酸钾标准溶液注入___(填“酸式”或“碱式”)滴定管中,滴定到终点。
(4)重复滴定三次,平均耗用cmol/LKMnO4标准溶液VmL,则原过氧化氢溶液中过氧化氢的质量分数为___。
(5)若滴定前仰视滴定管读数,滴定后平视,则测定结果___(填“偏高”、“偏低”或“不影响”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】图中的曲线是表示其他条件一定时,2NO(g)+O2(g)2NO2(g) ΔH<0反应中NO的转化率与温度的关系曲线,图中标有a、b、c、d四点,其中表示未达到平衡状态,且v正>v逆的点是( )

A.a点
B.b点
C.c点
D.d点
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,将1.000 mol/L 盐酸滴入20.00 mL 1.000 mol/L 氨水中,溶液pH 和温度随加入盐酸体积变化曲线如图所示。下列有关说法正确的是
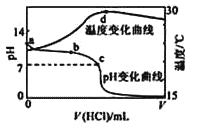
A.a 点由水电离出的c(H+)=1.0 × 10-14 mol/L
B.b 点c (NH4+) + c (NH3H2O) >c (Cl-)
C.c 点:c(Cl-)=c(NH4+)
D.d 点后,溶液温度略有下降的主要原因是NH3H2O电离吸热
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法或有关化学用语的表达正确的是( )
A. 在基态多电子原子中,p轨道电子能量一定高于s轨道电子能量
B. 因氧元素电负性比氮元素大,故氧原子第一电离能比氮原子第一电离能大
C. 基态Fe原子的外围电子排布图为![]()
D. 根据原子核外电子排布的特点,Cu在元素周期表中位于s区
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应属于氧化还原反应的是
A. CaCO3+2HCl=CaCl2+CO2↑+ H2O
B. CaO+H2O=Ca(OH)2
C. 2H2O2![]() 2H2O+O2↑
2H2O+O2↑
D. CaCO3![]() CaO+CO2↑
CaO+CO2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列与化工生产相关描述不合理的是

A.在合成氨工业中,低温、高压有利于提高合成氨平衡产率
B.在上图海水的综合利用中![]() 均为氧化还原反应
均为氧化还原反应
C.硫酸工业的基本流程:FeS2![]() SO2
SO2![]() SO3
SO3![]() H2SO4
H2SO4
D.可以采用如下方法制备硅:二氧化硅和适量的炭粉混合,高温反应得到粗硅,利用粗硅和氯气反应,其产物在高温下被氢气还原,从而得到较纯的硅
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com