
【题目】如图为某大型冶炼厂的冶炼加工的简化工艺流程。
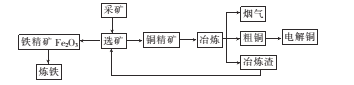
已知流程中“冶炼”的主要反应的化学方程式为Cu2S+O2 ![]() 2Cu+SO2
2Cu+SO2
(l)工业炼铁的主要设备是炼铁高炉,该设备中生成铁的主要反应的化学方程式为________
(2)“冶炼”产生烟气中的废气主要是 ___,从提高资源利用率和减排考虑,可将该烟气回收制备____。
(3)电解法炼铜时,阳极是 ___(填“纯铜板”或“粗铜板”);粗铜中含有的金、银以单的形式沉积在电解槽____(填“阳极”或“阴极”)的槽底,阴极的电极反应式是_____
(4)在精炼铜的过程中,电解质溶液中c(Fe2+)、c(Zn2+)会逐渐增大而影响进一步电解。
已知几种物质的溶度积常数(Ksp)如下表:

调节电解液的pH是除去杂质离子的常用方法。根据上表中溶度积数据判断,含有等物质的量浓度的Fe2+、Zn2+、Fe3+、Cu2+的溶液,随着pH的升高,最先沉淀下来的离子是____。一种方案是先加入过量的H2O2,再调节pH到4左右。加入H2O2后发生反应的离子方程式为____。
【答案】Fe2O3+3CO![]() 2Fe+3CO2 SO2 硫酸 粗铜板 阳极 Cu2++2e-=Cu Fe3+ 2Fe2++ H2O2+2H+=2Fe3++2H2O
2Fe+3CO2 SO2 硫酸 粗铜板 阳极 Cu2++2e-=Cu Fe3+ 2Fe2++ H2O2+2H+=2Fe3++2H2O
【解析】
(l)工业上用一氧化碳还原氧化铁来冶炼铁,据此写出反应方程式;
(2)根据Cu2S+O2 ![]() 2Cu+SO2可知,可以看出烟气中的主要废气是SO2,而SO2可以用于制备硫酸;
2Cu+SO2可知,可以看出烟气中的主要废气是SO2,而SO2可以用于制备硫酸;
(3)电解法炼铜时,阳极是粗铜板,铜在阳极溶解,比铜活泼性差的金属如金、银以单质的形式沉在电解槽底部,形成阳极泥;
(4)通过表中数据可知Fe(OH)3溶度积最小,所以随pH升高最先沉淀下来的离子是Fe3+;H2O2是强氧化剂,会把Fe2+ 氧化为铁离子,据此写出离子方程式。
(l)炼铁高炉设备中生成铁的主要反应的化学方程式为Fe2O3+3CO![]() 2Fe+3CO2;综上所述,本题答案是:Fe2O3+3CO
2Fe+3CO2;综上所述,本题答案是:Fe2O3+3CO![]() 2Fe+3CO2。
2Fe+3CO2。
(2)根据Cu2S+O2 ![]() 2Cu+SO2可知,可以看出烟气中的主要废气是SO2,而SO2可以用于制备硫酸,符合提高资源利用率和减排的目标;综上所述,本题答案是:SO2,硫酸。
2Cu+SO2可知,可以看出烟气中的主要废气是SO2,而SO2可以用于制备硫酸,符合提高资源利用率和减排的目标;综上所述,本题答案是:SO2,硫酸。
(3)电解法炼铜时,阳极是粗铜板,铜会放电生成铜离子,比铜活泼性差的金属如金、银以单质的形式沉在电解槽底部,形成阳极泥,方程式为Cu2++ 2e-=Cu;综上所述,本题答案是:粗铜板;阳极;Cu2++ 2e-=Cu。
(4)Fe(OH)3的溶度积最小,假设各种金属离子浓度均为1mol/L,Ksp[Fe(OH)3]=4×10-38=c(Fe3+)×c3(OH-),c3(OH-)=4×10-38,c(OH-)≈10-13mol/L,c(H+)=10-1mol/L,pH=1; Ksp[Cu(OH)2]=2.2×10-20= c(Cu2+)×c2(OH-),c2(OH-)=2.2×10-20,c(OH-)≈10-10mol/L,c(H+)=10-4mol/L,pH=4.所以,各种金属离子开始沉淀的pH最小的是Fe3+,所以随pH升高最先沉淀下来的离子是Fe3+;H2O2是强氧化剂,能够把Fe2+氧化为Fe3+,方程式为:2Fe2++ H2O2+2H+=2Fe3++2H2O;综上所述,本题答案是:Fe3+;2Fe2++H2O2+2H+=2Fe3++2H2O。


科目:高中化学 来源: 题型:
【题目】以下是依据一定的分类标准,对某些物质与水反应情况进行分类的图示。
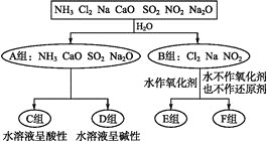
请根据你所学的知识,按要求填空:
(1)上述第一级分类标准(分成A,B组的依据)是____。
(2)F组中物质除了Cl2外还有____(填化学式)。
(3)A组中的CaO经常用作食品包装袋中的干燥剂,CaO所属的物质类型为____(用序号填空)。
①金属氧化物 ②碱性氧化物 ③碱 ④碱性干燥剂
CaO可作干燥剂的理由是____________(用化学方程式表示)。
(4)D组中NH3的水溶液呈弱碱性,用电离方程式表示其呈弱碱性的原因:________。
(5)由Al3+制备Al(OH)3,最好不选择D组中的NaOH溶液,说明理由:___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】桶烯结构简式如图所示,有关说法不正确的是 ( )
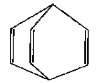
A.桶烯分子中所有的原子在同一平面上
B.桶烯在一定条件下能发生加聚反应
C.桶烯与苯乙烯(C6H5CH==CH2)互为同分异构体
D.桶烯中的一个氢原子被氯原子取代,所得产物只有两种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用甲烷与氯气发生取代反应制取副产品盐酸的设想已成为现实。某化学兴趣小组在实验室中模拟上述过程(反应缓慢不发生爆炸),其设计的模拟装置如下:
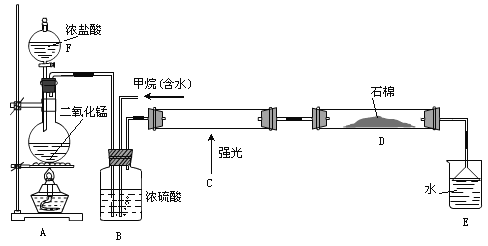
根据要求填空:
(1)仪器F的名称______________;A中反应的离子反应方程式___________________。
(2)B装置有三种功能:①控制气流速度;②均匀混合气体③______________________。
(3)为了除多余的氯气,D装置中的石棉网均匀附着KI粉末,你认为能否换成碱石灰______(填“能”或“不能”)。
(4)E装置的作用________。
A.收集气体 B.吸收氯气 C.防止倒吸 D.吸收氯化氢
(5)E装置中除了盐酸生成外,还含有有机物,从E中分离出盐酸的最佳方法:_____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在生物体内含量极少,但对维持生物体正常生命活动必不可少的元素有( )
A. Fe、Mn、Zn、Mg B. Zn、Cu、P、Ca
C. K、Mn、Cu、Mo D. Zn、Cu、B、Mn
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向NaOH和Na2CO3混合溶液中滴加0.1 mol·L1稀盐酸,CO2的生成量与加入盐酸的体积的关系如图。下列判断正确的是
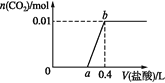
A. 在0~a范围内,只发生中和反应
B. ab段发生反应的离子方程式为:![]()
C. a=0.3
D. 原混合溶液中NaOH与Na2CO3的物质的量之比为1∶2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知![]() 和
和![]() 可以相互转化
可以相互转化![]()
![]() 。现将一定量
。现将一定量![]() 和
和![]() 的混合气体通入体积为1L的恒温恒容的密闭容器中,反应物浓度随时间变化关系如图。下列说法不正确的是
的混合气体通入体积为1L的恒温恒容的密闭容器中,反应物浓度随时间变化关系如图。下列说法不正确的是
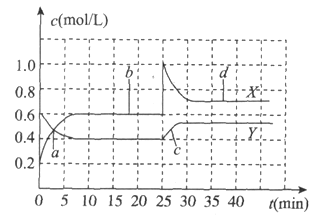
A. 反应进行至25min时,曲线发生变化的原因是加入0.4mol![]()
B. a、b、c、d四个点中,表示化学反应处于平衡状态的点是b和d
C. 图中共有两条曲线X和Y,其中曲线X表示![]() 浓度随时间的变化
浓度随时间的变化
D. 若要达到与d相同的状态,在25min时还可以采取的措施是适当缩小容器体积
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)①写出乙炔的结构式________________;②写出水玻璃中溶质的化学式________________。
(2)写出二氧化锰与浓盐酸共热反应的化学方程式:___________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲酸铝广泛用于化工、石油等生产上,120150℃左右分解。在0℃时,溶解度为16g,100℃时,溶解度为18.4g。
首先用废铝渣制取AI(OH)3固体,流程如下:
![]()
(1)调节pH用_________试剂为好。某同学在减压过滤时,布氏漏斗内没有得到产品,可能原因是______________________。
然后将氢氧化铝和甲醛依次加入到质量分数为50%的过氧化氢溶液中(投料物质的量之比依次为1∶3∶2),装置如图1.最终可得到含甲酸铝90%以上的优质产品。反应式为:2Al(OH)3+6HCHO+3H2O2=2Al(HCOO)3+6H2O+3H2↑。

(2)反应过程可看作两步进行,第一步______________(写出化学方程式),第二步为甲酸与Al(OH)3 反应生成甲酸铝。
(3)反应温度最好控制在30—70℃之间,温度不宜过高,主要原因是_________________。
(4)实验时需强力搅拌45 min,最后将溶液____________,抽滤,洗涤,干燥得产品。可用酸性KmnO4标准溶液滴定法来测定产品纯度,滴定起始和终点的滴定管液面位置见上图2, 则消耗的酸性KmnO4标准溶液体积为__________________mL。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com