

分析 (1)①根据图中各元素化合价变化分析;
②该反应中S元素化合价由-2价变为0价、O元素化合价由0价变为-2价,根据氧化还原反应中得失电子相等;
③欲使生成的硫单质中不含CuS,则硫离子不能剩余,硫离子完全被氧化为S单质;
(2)根据题意知,该反应是可逆反应,反应物是硫化氢,根据图象知,生成物中含有S元素的物质是氢气的一半,则生成物是S2和H2,再结合反应条件书写方程式;
(3)①d反应原理是硫化亚铁与铁离子反应,铁离子被还原生成亚铁离子,硫离子被氧化为硫酸根离子;
②a、用细菌冶铜时,正极为氧气放电,氧气得到电子,结合溶液中的H离子生成水;
b、负极黄铁矿中的硫失去电子,发生氧化反应生成硫单质.
解答 解:(1)①根据图中各元素化合价知,Cu元素化合价都是+2价、H元素化合价都是+1价、Cl元素化合价都是-1价,所以化合价不变的是Cu、H、Cl元素,故答案为:Cu、H、Cl;
②H2S不稳定,易被氧气氧化生成S单质,反应方程式为2H2S+O2=2S+2H2O,该反应中S元素化合价由-2价变为0价、O元素化合价由0价变为-2价,根据氧化还原反应中得失电子相等得,消耗O2的物质的量=$\frac{1mol}{2}$=0.5mol,故答案为:0.5mol;
③欲使生成的硫单质中不含CuS,则硫离子不能剩余,即硫离子完全被氧化为S单质,所以氧气必须过量,采取的措施为提高混合气体中空气的比例,故答案为:提高混合气体中空气的比例;
(2)根据题意知,该反应是可逆反应,反应物是硫化氢,根据图象知,生成物中含有S元素的物质是氢气的一半,则生成物是S2和H2,所以该反应方程式为2H2S$\frac{\underline{\;高温\;}}{\;}$2H2+S2,故答案为:2H2S$\frac{\underline{\;高温\;}}{\;}$2H2+S2;
(3)①d反应原理是硫化亚铁与铁离子反应,铁离子被还原生成亚铁离子,硫离子被氧化为硫酸根,离子反应方程式为:FeS2+14Fe3++8H2O=15Fe2++2SO42-+16H+,故答案为:FeS2+14Fe3++8H2O=15Fe2++2SO42-+16H+;
②a、正极为氧气放电,氧气得到电子,结合溶液中的H+离子生成水,故溶液中氢离子浓度减小,pH值增大,故答案为:增大;
b、负极黄铁矿中的硫失去电子,发生氧化反应生成硫单质,电极反应方程式为:CuFeS2-4e-=Cu2++Fe2++2S,故答案为:CuFeS2-4e-=Cu2++Fe2++2S.
点评 本题以S为载体考查氧化还原反应、电解原理等知识点,会正确分析图象中各个物理量的含义是解本题关键,再结合电解原理、氧化还原反应中各个物理量之间的关系、化学平衡有关知识来分析解答即可,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 一定条件下,乙酸乙酯、葡萄糖、蛋白质都能与水发生水解反应 | |
| B. | 乙二醇、丙氨酸均可发生缩聚反应 | |
| C. | 从海水中提取镁、溴、碘及从海水中生产烧碱、食盐、纯碱的过程中均涉及氧化还原反应 | |
| D. | 自然界中含有大量的游离态的硅,硅单质可用于制作计算机芯片 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 若X=5则HA为强酸 | |
| B. | 将a点与b点两溶液同时升高温度,则$\frac{c({A}^{-})}{c({B}^{-})}$ 减小 | |
| C. | 由b到c,Kw不变 | |
| D. | a、c两溶液中n(H+)相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
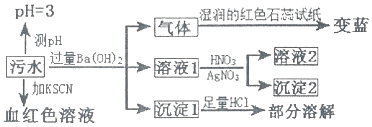
| A. | 该污水中一定存在Fe3+,不存在Fe2+ | |
| B. | 沉淀l为BaCO3和BaSO4 | |
| C. | 沉淀2可能为AgCl和Ag2SO4 | |
| D. | 该污水中一定存在NH4+、Cl-、Fe3+、SO42-离子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| X | Y | |||
| Z | W | Q |
| A. | X与Y形成的阴离子有XY32-、X2Y42- | |
| B. | Y分别与Z、W形成的化合物中化学键类型相同 | |
| C. | Q与Y可形成一种高效安全灭菌消毒剂 | |
| D. | W的最高价氧化物对应水化物的酸性比Q的弱 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 糖类、油脂和蛋白质在一定条件下一定都能水解 | |
| B. | 除去乙醇中的乙酸用分液的方法 | |
| C. | C5H10O2能与NaHCO3反应的结构有4种 | |
| D. | C8H10的同分异构体有三种,它们的性质相似 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 实验操作 | 现象 | 结论 | |
| A | 向25mL沸水中滴加5~6滴 FeCl3饱和溶液,持续加热煮沸 | 变为红褐色 | 最终制得 Fe(OH)3 胶体 |
| B | 欲收集酯化反应生成的乙酸乙酯并分离提纯,将导管伸入饱和Na2CO3溶液的液面下,再用分液漏斗分离 | 溶液分层,上层为无色油状液体 | 乙酸乙酯不溶于饱和Na2CO3 溶液,且密度比水小 |
| C | 淀粉溶液中加入几滴稀硫酸,水浴加热几分钟,再加入新制银氨溶液,水浴加热 | 无明显现象 | 淀粉未发生水解 |
| D | 两支盛有KI3溶液的向试管中,分别滴加淀粉溶液和AgNO3溶液 | 前者溶液变蓝,后者有黄色沉淀 | KI3溶液中存在平衡: I3-?I2+I- |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙二醇与丙三醇互为同系物 | B. | 乙烯和丙烯具有相似的化学性质 | ||
| C. | 淀粉和纤维素属于同分异构体 | D. | 乙酸与甲酸甲酯均易溶于水 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
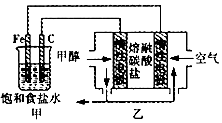
| A. | 乙池工作时,CO32-不断移向负极 | |
| B. | 乙池负极反应为CH3OH-6e-+3CO32-=4CO2+2H2O | |
| C. | 甲池中Fe电极发生的反应为2Cl--2e-=Cl2 | |
| D. | 为了使电池持续供电,工作时必须有CO2参与循环 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com