
| △c |
| △t |
| 0.25mol/L |
| 5min |
| 0.25x |
| 5 |


科目:高中化学 来源: 题型:
| A、分子是不断运动的 |
| B、分子能保持物质的化学性质 |
| C、分子之间有间隙 |
| D、分子是由原子构成的 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、NH4Cl |
| B、NaOH |
| C、Na2CO3 |
| D、Fe |
查看答案和解析>>
科目:高中化学 来源: 题型:
压强/MPa 体积分数/% 温度/℃ | 1.0 | 2.0 | 3.0 |
| 810 | 54.0 | a | b |
| 915 | c | 75.0 | d |
| 1000 | e | f | 83.0 |
| A、b>f |
| B、K(1000℃)>K(810℃) |
| C、915℃、2.0MPa时E的转化率为60% |
| D、该反应的△S>0 |
查看答案和解析>>
科目:高中化学 来源: 题型:
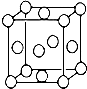 某配位化合物为深蓝色晶体,由原子序数依次增大的A、B、C、D、E五种元素组成,其原子个数比为l4:4:5:1:1. 其中C、D元素同主族且原子序数D为C的二倍,E元素的外围电子排布为(n-1)dn+6nsl,回答下列问题.
某配位化合物为深蓝色晶体,由原子序数依次增大的A、B、C、D、E五种元素组成,其原子个数比为l4:4:5:1:1. 其中C、D元素同主族且原子序数D为C的二倍,E元素的外围电子排布为(n-1)dn+6nsl,回答下列问题.查看答案和解析>>
科目:高中化学 来源: 题型:
| 1 |
| 2 |
| 3 |
| 2 |
| A、+859kJ/mol |
| B、-859kJ/mol |
| C、-1403kJ/mol |
| D、+1403kJ/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 1 |
| 2 |
| A、-283.01kJ?mol-1 |
| B、+172.51kJ?mol-1 |
| C、+283.1kJ?mol-1 |
| D、+504.00kJ?mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| O | 2- 4 |
| O | - 4 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com