常温下,pH=11的氨水溶液和pH=1的盐酸溶液等体积混合后(不考虑混合后溶液体积的变化),恰好完全反应,则下列说法正确的是( )
A.弱碱的浓度大于强酸的浓度
B.反应完全后的溶液呈碱性
C.原氨水中有1%的含氮微粒为NH4+
D.反应后的溶液中NH4+、NH3?H2O与NH3三种微粒的平衡浓度之和为0.1 mol?L-1
【答案】
分析:常温下,pH=11的氨水溶液和pH=1的盐酸溶液等体积混合后(不考虑混合后溶液体积的变化),恰好完全反应,反应后生成氯化铵,则c(碱)=c(酸),以此来解答.
解答:解:A.因恰好完全反应,则等体积混合时,酸碱的浓度相等,故A错误;
B.反应后生成氯化铵,水解显酸性,故B错误;
C.pH=11的氨水溶液,c(碱)=0.1mol/L,c(OH
-)=c(NH
4+)=10
-3mol/L,则原氨水中有1%的含氮微粒为NH
4+,故C正确;
D.反应后的溶液中NH
4+、NH
3?H
2O与NH
3三种微粒的平衡浓度之和为
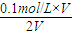
=0.05mol?L
-1,故D错误;
故选C.
点评:本题考查酸碱混合溶液中离子浓度的关系,注意恰好完全反应为解答的关键,明确反应后生成氯化铵即可解答,结合物料守恒及电离即可解答,题目难度中等.

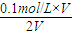 =0.05mol?L-1,故D错误;
=0.05mol?L-1,故D错误;

 阅读快车系列答案
阅读快车系列答案