



 举一反三同步巧讲精练系列答案
举一反三同步巧讲精练系列答案 口算与应用题卡系列答案
口算与应用题卡系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 大气压强对许多物理、化学实验有着重要影响.制取HCl并完成喷泉实验:
大气压强对许多物理、化学实验有着重要影响.制取HCl并完成喷泉实验:查看答案和解析>>
科目:高中化学 来源: 题型:
 图中的实验装置可用于制取乙炔.请填空:
图中的实验装置可用于制取乙炔.请填空:查看答案和解析>>
科目:高中化学 来源: 题型:
 (1)在一个恒温恒容的密闭容器中,可逆反应N2(g)+3H2(g)?2NH3(g)△H<0达到平衡的标志是
(1)在一个恒温恒容的密闭容器中,可逆反应N2(g)+3H2(g)?2NH3(g)△H<0达到平衡的标志是查看答案和解析>>
科目:高中化学 来源: 题型:
| A、28g C2H4所含共用电子对数目为4NA |
| B、1mol甲基(-CH3)所含的电子总数为7NA |
| C、标准状况下,11.2L己烷所含分子数为0.5NA |
| D、0.5mol 1,3-丁二烯分子中含有C=C双键数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、CaCl2 |
| B、AgNO3 |
| C、Ba(OH)2 |
| D、H2SO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、质量 | B、密度 |
| C、电子总数 | D、原子总数 |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、 |
B、 |
C、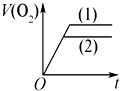 |
D、 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com