
| A. | 淡黄色试液$\stackrel{NaOH溶液}{→}$红褐色沉淀 说明原溶液中一定含有FeCl3 | |
| B. | H3PO3+2NaOH(足量)=Na2HPO3+2H2O,H3PO3属于三元酸 | |
| C. | 新收集的酸雨$\stackrel{Ba(NO_{3})_{2}溶液}{→}$白色沉淀酸雨中一定含有SO42- | |
| D. | CaO$\stackrel{H_2{O}}{→}$Ca(OH)2$\stackrel{Na_{2}CO_{3}}{→}$NaOH 用生石灰制备NaOH溶液 |
分析 A.能和NaOH溶液产生红褐色沉淀的离子是Fe3+,原溶液中的溶质为可溶性铁盐;
B.NaOH足量,生成的Na2HPO3为正盐;
C.新收集的酸雨含亚硫酸,与硝酸钡发生氧化还原反应生成硫酸钡;
D.CaO与水反应生成氢氧化钙,氢氧化钙与碳酸钠反应生成碳酸钙和NaOH.
解答 解:A.能和NaOH溶液产生红褐色沉淀的离子是Fe3+,原溶液中的溶质为可溶性铁盐,淡黄色试液$\stackrel{NaOH溶液}{→}$红褐色沉淀 说明原溶液中一定含Fe3+,但溶质不一定是FeCl3,故A错误;
B.NaOH足量,生成的Na2HPO3为正盐,则H3PO3属于二元酸,故B错误;
C.新收集的酸雨含亚硫酸,与硝酸钡发生氧化还原反应生成硫酸钡,不能说明是否含SO42-,故C错误;
D.CaO与水反应生成氢氧化钙,氢氧化钙与碳酸钠发生复分解反应生成碳酸钙和NaOH,则由实验操作可用生石灰制备NaOH溶液,故D正确;
故选D.
点评 本题考查化学实验方案评价,为高频考点,涉及离子检验、物质检验、物质制备等知识点,明确离子及物质性质是解本题关键,注意:离子检验时要排除其它离子干扰,题目难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| 甲 | 乙 | 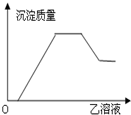 | |
| A | AlCl3、Mg(NO3)2、HNO3 | NaOH | |
| B | Na2CO3、NH4HCO3、Na2SO4 | Ba(OH)2 | |
| C | NH4NO3、Al(NO3)3、Fe(NO3)3、HCl | NaOH | |
| D | NaAlO2、氨水、NaOH | H2SO4 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 33.3% | B. | 40% | C. | 60% | D. | 75% |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
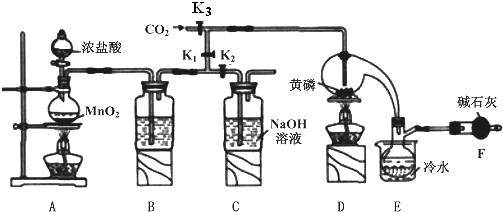
| 物质 | 熔点/℃ | 沸点/℃ |
| PCl3 | -112 | 75.5 |
| POCl3 | 2 | 105.3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
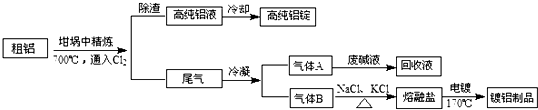
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
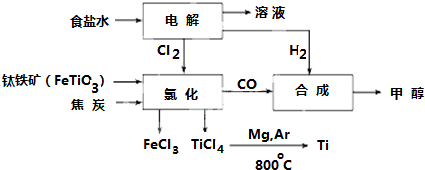
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 2NH3+3CuO→3Cu+N2+3H2O | B. | 2Na+2NH3→2NaNH2+H2↑ | ||
| C. | 4NH3+6NO→5N2+6H2O | D. | 3SiH4+4NH3→Si3N4+12H2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com