
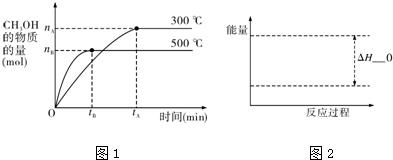
分析 (1)当反应达到平衡状态时,正逆反应速率相等,各物质的浓度、百分含量不变,以及由此衍生的一些量也不发生变化,据此解答,解题时要注意,选择判断的物理量,随着反应的进行发生变化,当该物理量由变化到定值时,说明可逆反应到达平衡状态;
(2)将容器的容积压缩到原来的$\frac{1}{2}$,压强增大,反应速率增大,平衡向正反应方向移动,以此判断;
(3)根据该反应放热,生成物的总能量小于反应物的总能量,△H<O;
解答 解:(1)a、平衡时各物质的浓度保持不变,CH3OH、H2O、CO2、H2的浓度都不再发生变化,说明到达平衡,故a正确;
b、容器的体积不变,混合气体的质量不变,混合气体的密度始终不变,混合气体密度不变,不能说明到达平衡,故b错误;
c、混合气体的质量不变,混合气体的物质的量增大,随反应进行平均相对分子质量减小,混合气体的平均相对分子质量不变,说明到达平衡,故c正确;
d、v生成(CH3OH)=v消耗(CO)都表示正反应速率,自始至终都按1:1进行,不能说明到达平衡,故d错误.
故答案为:a、c;
(2)将容器的容积压缩到原来的$\frac{1}{2}$,压强增大,正、逆反应速率都增大,平衡向正反应方向移动,CH3OH的物质的量增加,浓度增大,氢气的物质的量减少,但浓度增大,甲醇的物质的量增多,浓度增大,故有$\frac{c({H}_{2})}{c(C{H}_{3}OH)}$=$\frac{n({H}_{2})}{n(C{H}_{3}OH)}$减小,
故答案为:c、d;
(3)该反应放热,生成物的总能量小于反应物的总能量,△H<O,图象为: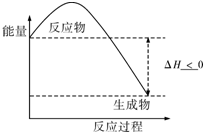 ;
;
故答案为: .
.
点评 本题主要考查化学反应速率、平衡的移动、平衡状态的判断等,难度不大,注意基础知识的理解掌握.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 蒸发溶剂 | B. | 升高温度 | C. | 降低温度 | D. | 加入KN03固体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | c(CH3COOH):①>② | B. | c(CH3COO-):①>② | ||
| C. | c(CH3COOH)+c(CH3COO-):①=② | D. | c(CH3COO-)+c(OH-):①<② |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
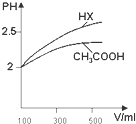 回答下列问题:
回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:实验题
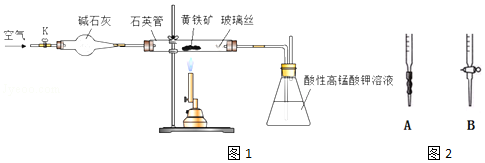
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
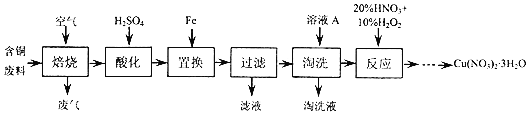

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| A | B |
| ②使溴的四氯化碳溶液褪色; ②比例模型为: 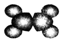 ③能与水在一定条件下反应生成醇 | ①由C、H两种元素组成; ②球棍模型为: 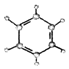 |
 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com