
����Ŀ����������Ҫ�ɷ�Al2O3���������� SiO2��Fe2O3���ʡ�������ͼ�Ʊ�����
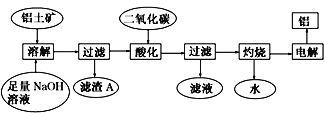
��֪ 2Na2SiO3+2NaAlO2+2H2O === Na2Al2Si2O8��+4NaOH�� �ش��������⣺
��1���ڹ������̵��岽�У����������ʵ���������ƾ��ơ�����������ǯ��������֮�⣬����Ҫ_____________��_________________________��
��2��Na2Al2Si2O8����������ʽΪ_________________________��
��3������A���ಽ���Ƶôֹ� ����д���ɶ��������Ƶôֹ�Ļ�ѧ����ʽ________________��
��4���ڹ������̵������У�ͨ������Ķ�����̼ʱ���÷�Ӧ�����ӷ���ʽ��_______________�� �õ�����Һ������Ba(OH)2��Һ��Ӧ����Ҫ���ӷ���ʽΪ ____________________��
��5����a g����������һϵ�в���֮�����յõ�b g Al��������ʵ������в��������������� ����˵����ȷ����____________�� ��NA��ʾ�����ӵ�������
A.�������� Al3+��ĿС��![]()
B.��������Al2O3���ʵ���С��b/54 mol
C.����������Ԫ�ص���������Ϊ![]() ��100�G
��100�G
���𰸡� ������ ���ż� Na2O��Al2O3��2SiO2 SiO2+2C![]() Si+2CO�� AlO2��+CO2+2H2O == Al(OH)3��+ HCO3- Ba2++OH-+HCO3-== BaCO3��+ H2O A
Si+2CO�� AlO2��+CO2+2H2O == Al(OH)3��+ HCO3- Ba2++OH-+HCO3-== BaCO3��+ H2O A
�����������������Ҫ�ɷ���Al2O3����������SiO2��Fe2O3�����ʣ������������������ƣ�������������������NaOH��Һ��Ӧ�������κ�ˮ��ֻ������������Ӧ�������Ϣ��֪������Na2Al2Si2O8���������˺������AΪFe2O3��Na2Al2Si2O8����Һ�ö�����̼�ữʱ����NaAlO2��ȫת��ΪAl(OH)3����Ӧ�����ӷ���ʽΪ��AlO2��+CO2+2H2O��Al(OH)3��+HCO3�������˵������������������յ�������������������õ���������
��1���������������ʵ���������ƾ��ơ�����������ǯ��������֮�⣬����Ҫ�����������żܡ���2�����ݻ�ѧʽNa2Al2Si2O8��֪����������ʽΪNa2O��Al2O3��2SiO2����3��������̼��������跴Ӧ�Ƶôֹ�Ļ�ѧ����ʽΪSiO2+2C![]() Si+2CO������4���������Ϸ�����֪ͨ������Ķ�����̼ʱ���÷�Ӧ�����ӷ���ʽΪAlO2��+CO2+2H2O��Al(OH)3��+HCO3�����õ�����Һ�к���̼�����ƣ�������Ba(OH)2��Һ��Ӧ����Ҫ���ӷ���ʽΪBa2++OH-+HCO3-==BaCO3��+H2O����5��A�����������ȫ������������ɣ��������ӵ����ʵ�����
Si+2CO������4���������Ϸ�����֪ͨ������Ķ�����̼ʱ���÷�Ӧ�����ӷ���ʽΪAlO2��+CO2+2H2O��Al(OH)3��+HCO3�����õ�����Һ�к���̼�����ƣ�������Ba(OH)2��Һ��Ӧ����Ҫ���ӷ���ʽΪBa2++OH-+HCO3-==BaCO3��+H2O����5��A�����������ȫ������������ɣ��������ӵ����ʵ�����![]() �����ڻ��������ʣ�������������Al3+��ĿС��
�����ڻ��������ʣ�������������Al3+��ĿС��![]() ��A��ȷ��B��bg�������ʵ�����b/27mol�����ڻ���Na2Al2Si2O8�������������ԭ���غ��֪�������������������ʵ�������b/54mol��B������C�����ڻ���Na2Al2Si2O8������������������Ԫ�ص�������������
��A��ȷ��B��bg�������ʵ�����b/27mol�����ڻ���Na2Al2Si2O8�������������ԭ���غ��֪�������������������ʵ�������b/54mol��B������C�����ڻ���Na2Al2Si2O8������������������Ԫ�ص�������������![]() ��100�G��C����ѡA��
��100�G��C����ѡA��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ��ʾװ�ã�������ͷ�ι��е�ˮ���뼯��ƿ�У��������۲쵽������д���йص����ӷ���ʽ�� 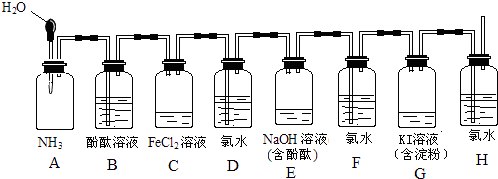
��1��A�е�����Ϊ �� ��ѧ����ʽ ��
��2��C�е�����Ϊ �� ���ӷ���ʽ ��
��3��E�е�����Ϊ �� ���ӷ���ʽ ��
��4��G�е�����Ϊ �� ���ӷ���ʽ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������������ɢϵ�������ǣ� ��
A.��������ֱ����1nm~100nm֮��B.�������Ӵ����
C.�������Ӳ��ܴ�����ĤD.���������ܹ����������˶�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������������ʽ��ͬ�����Ȳ���ͬϵ�Ҳ����ͬ���칹�壬�ֲ�����ͬ�����ŵ��ǣ�������
A.![]() ��
�� ![]()
B.��Ȳ�ͱ�
C.![]() ��
�� ![]()
D.��ȩ�ͼ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��Һ��ֻ�������������е�ȫ���֣� Ag+��Fe3+��Al3+��H+��SO42-��CO32-��OH-��Cl-��ȡ����Һ������ʵ�飺
�ٹ۲���Һ��ۣ� ��Һ����ɫ��
��ȡ��������Һ����Ba(NO3)2��Һ�� ������
��ȡ����Һ 100 mL����������εμ� 1 mol/L��NaOH��Һ�����������ɳ������ʵ������������ NaOH ��Һ�������ϵ��ͼ��ʾ������ʵ��ش��������⣺
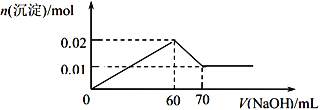
��1��������Һ�������ӵ����ӷ���ʽΪ________________________________��
��2����������ʵ���ƶϣ���Һ�и����ӵ����ʵ���Ũ�ȷֱ�Ϊ________________________________��
��3����ȡ������Һ 100 mL������������ˮ����ˣ��ٽ����ó���ϴ�ӡ����գ����ù������������ʵ���Ϊ_____________mol��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ɷ��Ǹ��л�ѧѧϰ���õķ���֮һ��ij��ѧ�о���ѧϰС����ѧϰ�ˡ���ѧ��Ӧԭ���������������µĹ����ܽ������ȷ���ǣ� �� �ٳ����£�pH=3�Ĵ�����Һ��pH=11��NaOH��Һ�������ϣ�����c��Na+��+c��H+��=c��OH����+c��CH3COO����
�ڶ��ѽ�����ѧƽ���ij���淴Ӧ�����ı�����ʹ��ѧƽ��������Ӧ�����ƶ�ʱ��������İٷֺ���һ������
�۳����£�AgCl��ͬ���ʵ���Ũ�ȵ�CaCl2��NaCl��Һ�е��ܽ����ͬ
�ܳ����£���֪�������ƽ�ⳣ��ΪKa�������ˮ��ƽ�ⳣ��ΪKh��ˮ�����ӻ�ΪKw��KaKh=Kw
�ݵ�⾫��ͭʱ���������Һ��ͭ����Ũ�Ȳ��䣮
A.�٢�
B.�٢ڢ�
C.�٢ڢܢ�
D.�٢ڢۢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Ҫ�Ƶýϴ���ZnS��������ZnCl2��Һ�м�����Լ��ǣ� ��
A.H2SB.NaHSC.NH4HSD.(NH4)2S
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����н�����ʵ�ķ���ʽ����ȷ���ǣ� ��
A.�������죺2Fe+Al2O3 ![]() 2Al+Fe2O3
2Al+Fe2O3
B.��ҵ�̵���N2+3H2 ![]() 2NH3
2NH3
C.�ô�������ۣ�CO32��+H2OHCO3��+OH��
D.��ʪ��ĵ���KI��ֽ����Cl2��Cl2+2I���T2Cl��+I2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������ͬ��Ba(OH)2��Һ�У��ֱ�������ʵ���Ũ����ȵ�H2SO4��NaHSO4��Һ���䵼�������������Һ����仯����������ͼ��ʾ�����з�������ȷ���ǣ� ��

A. �ٴ����μ�H2SO4��Һ�ı仯����
B. b�㣬��Һ�д������ڵ�������Na+��OH�C
C. c�㣬����Һ�к�����ͬ����OH�C
D. a��d�����Ӧ����Һ��������
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com