
| A. | H2(g)+Cl2(g)═$\frac{1}{2}$HCl(g)△H=+92.4KJ/mol | B. | H2(g)+Cl2(g)═$\frac{1}{2}$HCl(g)△H=-92.4KJ/mol | ||
| C. | H2(g)+Cl2(g)═2HCl(g)△H=-184.8KJ/mol | D. | H2(g)+Cl2(g)═2HCl(l)△H=+184.8 KJ/mol |
分析 依据热化学方程式的书写原则和注意问题写出,标注聚集状态和焓变,标准状况下11.2L氢气物质的量=$\frac{11.2L}{22.4L/mol}$=0.5mol,结合热化学方程式计算;
解答 解:标准状况下11.2L氢气物质的量=$\frac{11.2L}{22.4L/mol}$=0.5mol,1mol氢气在氯气中充分燃烧生成氯化氢气体时放出热量=$\frac{92.4KJ}{0.5mol}$=184.8kJ,
1mol氢气在氯气中充分燃烧生成氯化氢气体时放出184.6kJ的热量,对应的热化学方程式为:H2(g)+Cl2(g)=2HCl(g)△H=-184.6 kJ•mol-1,AB化学方程式错误,D反应焓变应为负值,C正确,
故选C.
点评 本题考查了热化学方程式的书写方法,注意物质聚集状态和对饮焓变的计算是解题关键,题目较简单.


科目:高中化学 来源: 题型:选择题
| A. | MgO$\stackrel{HCl}{→}$MgCl2溶液$\stackrel{电解}{→}$Mg | |
| B. | CH≡CH$→_{催化剂△}^{HCl}$CH2=CHCl$→_{△}^{催化剂}$ | |
| C. | HCHO$\stackrel{O_{2}}{→}$HCOOH$→_{NaOH}^{CH_{2}OH}$HCOOCH3 | |
| D. | CH2═CH2$→_{催化剂△}^{O_{2}}$CH3CHO$→_{△}^{银氨溶液}$CH3COOH |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
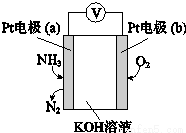
| A. | b极为负极 | |
| B. | a极的电极反应式为2NH3+3O2--6e-═N2+3H2O | |
| C. | 反应消耗的NH3与O2的物质的量之比为4:5 | |
| D. | 该传感器在工作过程中KOH的物质的量不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 56(m-n)g | B. | 56(n-m)g | C. | 56ng | D. | 56(m-2n)g |
查看答案和解析>>
科目:高中化学 来源:2016-2017学年山东省高一上10月月考化学试卷(解析版) 题型:选择题
若Cmol的AlCl3溶液V1ml 加水稀释至V2ml,稀释后溶液中Cl-物质的量浓度为
A.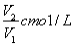 B.
B.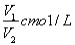 C.
C.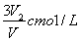 D.
D.
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 保持其它条件不变,加入少量W,平衡将逆向移动 | |
| B. | 保持温度和体积不变,加入少量X,正、逆反应速率均增大 | |
| C. | 保持体积不变,升高温度,正反应速率增大,逆反应速率降低 | |
| D. | 保持温度不变,将体积压缩一半,新平衡时体系压强变为原来的两倍 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com