
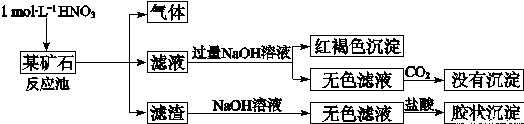
欲探究某矿石可能是由FeCO3、SiO2、Al2O3中的一种或几种组成,探究过程如下图所示。已知:碳酸不能溶解Al(OH)3沉淀。
(1)Si在周期表中的位置是 。
(2)下列说法正确的是 。
a.酸性:H2CO3>H2SiO3
b.结合质子的能力:CO32->AlO2->HCO3-
c.稳定性:H2O>CH4>SiH4
d.离子半径:O2-<Al3+
(3)该矿石的组成是 ,滤渣和NaOH溶液反应的离子方程式是 。
(4)该矿石和1 mol L-1HNO3反应的离子方程式 。
(5)工业上依据上述实验原理处理该矿石,将反应池逸出的气体与一定量的O2混合循环通入反应池中,目的是 ;若处理该矿石2.36×103 kg,得到滤渣1.2×103 kg,理论上至少需要1 mol L-1 HNO3的体积为 L。
(1)(1分)第三周期、ⅣA族 (2)(2分)ac
(3)(2分)FeCO3和SiO2 (2分)SiO2+2OH— = SiO32—+H2O
(4)(2分)3FeCO3+10H++NO3— = 3Fe3+ +3CO2↑+NO↑+5H2O
(5)(2分)NO循环使用能减少环境污染,NO跟H2O、O2反应后又得到硝酸提高原料利用率 (2分)3×104
【解析】(1)硅是14号元素,位于第三周期、ⅣA族。
(2)考查元素周期律的应用。酸越弱相应的酸根越容易结合氢离子,所以AlO2- > CO32->HCO3-。离子半径:O2->Al3+,所以ac正确。
(3)矿石加入硝酸生成气体,并且有不溶性物质存在,说明含有FeCO3、SiO2。滤液加入过量的氢氧化钠然后再通入二氧化碳没有沉淀,说明没有Al2O3。
(4)FeCO3中铁的化合价是+2价,和硝酸反应发生氧化还原反应,方程式为3FeCO3+10H++NO3— = 3Fe3+ +3CO2↑+NO↑+5H2O。
(5)反应池逸出的气体是NO,属于大气污染物,因此要循环使用,防止污染空气。NO溶于水和因为反应重新生成硝酸,可以重复使用。矿石是2.36×103 kg,得到滤渣是1.2×103 kg,所以FeCO3是1160kg,物质的量是10000mol,可失去10000mol电子,根据原子得失守恒可得需要硝酸30000mol,故理论上至少需要1 mol L-1 HNO3的体积为3×104L


科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
欲探究某矿石可能是由FeCO3、SiO2、Al2O3中的一种或几种组成,探究过程如下图所示。已知:碳酸不能溶解Al(OH)3沉淀。
(1)Si在周期表中的位置是 。
(2)下列说法正确的是 。
a.酸性:H2CO3>H2SiO3
b.结合质子的能力:CO32->AlO2->HCO3-
c.稳定性:H2O>CH4>SiH4
d.离子半径:O2-<Al3+
(3)该矿石的组成是 ,滤渣和NaOH溶液反应的离子方程式是 。
(4)该矿石和1 mol L-1HNO3反应的离子方程式 。
(5)工业上依据上述实验原理处理该矿石,将反应池逸出的气体与一定量的O2混合循环通入反应池中,目的是 ;若处理该矿石2.36×103 kg,得到滤渣1.2×103 kg,理论上至少需要1 mol L-1 HNO3的体积为 L。
查看答案和解析>>
科目:高中化学 来源:2014届四川成都棠湖中学外语实验学校高二5月月考化学卷(解析版) 题型:填空题
欲探究某矿石可能是由FeCO3、SiO2、Al2O3中的一种或几种组成,探究过程如下图所示。(已知:碳酸不能溶解Al(OH)3沉淀)
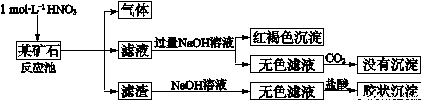
(1)用滤渣制备粗硅的化学反应方程式为
(2)下列说法正确的是
a.酸性:H2CO3>H2SiO3 b.结合质子的能力:CO> AlO2->HCO3-
c.稳定性:H2O>CH4>SiH4 d.离子半径:O2-<Al3+
(3)滤渣和NaOH溶液反应的离子方程式是
通过 现象说明此矿山中不含Al2O3
(4)该矿石和稀HNO3发生氧化还原反应的离子方程式为
(5)工业上依据上述实验原理处理该矿石,将反应池逸出的气体与一定量的O2混合循环通入反应池中,主要两个目的是 , ;
若处理该矿石2.36×103 kg,得到滤渣1.2×103 kg ,理论上至少需要1 mol L-1 HNO3的体积为 L。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com