
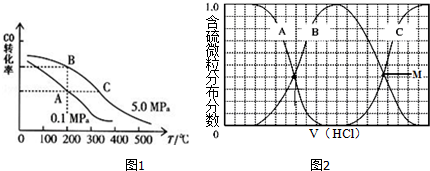
分析 (1)达到化学平衡时,正逆反应速率相等,各个组分的浓度不随着时间的变化而变化,根据化学平衡的特征,由此衍生出的一系列物理量都不变,据此来判断;
(2)化学反应的平衡常数随着温度的变化而变化;增大压强或增大H2的浓度,可提高CO平衡转化率的同时加快反应速率;
(3)①向等物质的量浓度Na2S、NaOH混合溶液中滴加稀盐酸,盐酸和氢氧化钠先反应,然后和硫化钠反应,结合图1所示H2S、HS-、S2-的分布分数进行解答;NaHS的含量先增加后减少;根据物料守恒可求得滴加过程中,溶液中微粒浓度大小关系;
②根据电离平衡和水解规律可得M点时,溶液呈中性.
解答 解:(1)A.每消耗1molCO的同时生成2molH2,能证明正逆反应速率是相等的,故A错误;
B、该反应是一个前后气体系数和变化的反应,当混合气体总物质的量不变,达到额化学平衡状态,故B错误;
C.生成CH3OH的速率与消耗CO的速率相等,不能证明正逆反应速率是相等的,此时不一定达到化学平衡,故c正确
D.CH3OH、CO、H2的浓度都不再发生变化,是化学平衡状态的特征,故D错误.
故选C;
(2)根据图中CO的平衡转化率(α)与温度、压强的关系,当温度升该时,一氧化碳的转化率逐渐减小,所以化学平衡向左移动,所以平衡常数减小,又C点温度比B高,所以K(B)>K(C),增大压强或增大H2的浓度,可提高CO平衡转化率的同时加快反应速率
故答案为:>; 由图可知,随着温度的升高CO的转化率降低,该反应为放热反应,放热反应的平衡常数随温度升高而减小;增大压强或增大H2的浓度;
(3)①向等物质的量浓度Na2S、NaOH混合溶液中滴加稀盐酸,盐酸和氢氧化钠先反应,然后和硫化钠反应,A表示含硫微粒浓度减小为S2-,B先增加后减少为HS-,C浓度一直在增加为H2S,向等物质的量浓度Na2S、NaOH混合溶液中滴加稀盐酸,因体积相同,设Na2S、NaOH各为1mol,则n(Na)=3n(S),溶液中含硫的微粒为HS-、S2-、H2S,则c(Na+)=3[c(H2S)+c(HS-)+c(S2-)],或溶液中存在电荷守恒得到c(Na+)=c(Cl-)+c(OH-)+c(HS-)+2c(S2-)-c(H+);
故答案为:HS-;c(Na+)=3[c(H2S)+c(HS-)+c(S2-)],或c(Na+)=c(Cl-)+c(OH-)+c(HS-)+2c(S2-)-c(H+);
②B为HS-,C表示H2S,当滴加盐酸至M点时,表示两者含量相等,所以Ka=$\frac{c(HS)•c({H}^{+})}{c({H}_{2}S)}$=c(H+)=1×10-7,故答案为:1×10-7.
点评 本题考查盖斯离子浓度大小比较、平衡状态判断等,侧重于学生的分析能力的考查,为高考常见题型,题目难度较大,注意利用守恒思想比较溶液中微粒浓度大小.


科目:高中化学 来源: 题型:选择题
| A. | Al2O3→NaAlO2 | B. | Fe→FeCl3 | C. | Na2O→Na2CO3 | D. | SiO2→H2SiO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 实验室通常用如右图所示的装置来制取氨气.回答下列问题:
实验室通常用如右图所示的装置来制取氨气.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 碳酸钠溶液和盐酸反应Na2CO3+2H+═2Na++CO2↑+H2O | |
| B. | 过氧化钠和水反应2Na2O2+2H2O═4Na++4OH-+O2↑ | |
| C. | 钠跟水反应Na+H2O═Na++OH-+H2↑ | |
| D. | 碳酸氢钠溶液跟稀硝酸反应HCO3-+H+═CO2↑+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 离子半径:A2->D->B+ | |
| B. | 元素B、C的最高价氧化物对应水化物的碱性:B>C | |
| C. | 简单氢化物的稳定性:A>D | |
| D. | A与B形成的化合物中可能既有离子键又有共价键 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 溴化亚铁溶液中通入足量氯气:2Fe2++2Br-+2Cl2═2Fe3++Br2+4Cl- | |
| B. | Cl2与石灰水反应:Cl2+2OH-═Cl-+ClO-+H2O | |
| C. | 四氧化三铁与稀硝酸反应:Fe3O4+8H+═Fe2++2Fe3++4H2O | |
| D. | 向次氯酸钙溶液中通入少量SO2:Ca2++2ClO-+SO2+H2O═CaSO3↓+2HClO |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,14g CO所含质子数为7NA | |
| B. | 22g某气体含分子数为0.5NA,则其摩尔质量为44 | |
| C. | 标准状况下,33.6LCH4中含H原子数为6NA | |
| D. | 1 mol Na 完全反应时,失去NA个电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 难溶于水的BaCO3是弱电解质 | |
| B. | 0.1mol/L的CH3COOH溶液中H+浓度为0.1mol/L | |
| C. | 强电解质水溶液的导电能力一定比弱电解质的强 | |
| D. | 电解质溶液导电的原因是溶液中有自由移动的阴、阳离子 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com