
分析 (1)物质导电的条件:含有自由电子或者自由移动的离子;
电解质:在水溶液中或熔融状态下能导电的化合物;例:酸、碱、盐,金属氧化物等;
非电解质:在水溶液中和熔融状态下不能导电的化合物;例:有机物,非金属氧化物等;
单质和混合物既不是电解质也不是非电解质;
硫酸氢钠为强电解质,在水溶液中完全电离生成钠离子、氢离子、硫酸根离子;
氢氧化钙少量,反应生成碳酸钠、碳酸钙和水;
(2)反应KClO3+6HCl(浓)=KCl+3Cl2↑+3H2O中,只有Cl元素化合价发生变化,Cl元素化合价分别由+5价、-1价变化为0价,当有3mol Cl2生成时,转移5mol电子;依据n=$\frac{V}{Vm}$计算生成氯气的物质的量,依据方程式计算转移电子数目;
(3)根据化学式改写成相应的氧化物的形式,按照活泼金属氧化物.较活泼金属氧化物.SiO2.H2O的顺序来书写,并要遵守原子守恒来分析解答;硅为+4价,氧为-2价,钙和镁均为+2价,氢为+1价,根据化合价判断氧化物的化学式,并检查原子个数确定化学式前的系数.
解答 解:(1)①氢氧化钠固体不含自由电子或者自由移动的离子,不导电,在水溶液中或熔融状态下能导电的化合物,是电解质;
②铜丝含有自由电子,能导电,是单质,既不是电解质也不是非电解质;
③氯化氢气体不含自由电子或者自由移动的离子,不导电,在水溶液中能导电的化合物,是电解质;
④稀硫酸含有自由移动的离子,能够导电,是混合物,既不是电解质也不是非电解质;
⑤CO2气体不含自由电子或者自由移动的离子,不导电,本身不能电离成自由移动的离子,属于非电解质;
⑥氨水含有自由移动的离子,能够导电,是混合物,既不是电解质也不是非电解质;
⑦碳酸氢钠粉末不含自由电子或者自由移动的离子,不导电,在水溶液中或熔融状态下能导电的化合物;
⑧蔗糖晶体 不含自由电子或者自由移动的离子,不导电,在水溶液中和熔融状态下不能导电的化合物,属于非电解质;
⑨熔融氯化钠含有自由移动的离子,能导电,在水溶液中或熔融状态下能导电的化合物,是电解质;
⑩硫酸氢钠固体,不含自由电子或者自由移动的离子,不导电,在水溶液中或熔融状态下能导电的化合物,是电解质;
所以:上述状态下能导电的是②④⑥⑨,属于电解质的是①③⑦⑨⑩,属于非电解质的是⑤⑧;
硫酸氢钠为强电解质,在水溶液中完全电离生成钠离子、氢离子、硫酸根离子,电离方程式:NaHSO4=Na++H++SO42-;
氢氧化钙少量,反应生成碳酸钠、碳酸钙和水,反应的离子方程式:Ca2++2OH-+2HCO3-=CaCO3↓+2H2O+CO32-;
故答案为:②④⑥⑨;①③⑦⑨⑩;⑤⑧;NaHSO4=Na++H++SO42-; Ca2++2OH-+2HCO3-=CaCO3↓+2H2O+CO32-;
(2)该反应中,氯酸钾中氯元素的化合价由+5价变为0价,所以氯酸钾是氧化剂,HCl中Cl元素化合价由-1价升高到0价被氧化生成Cl2为氧化产物,用单线桥表示为: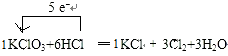 ;
;
依据方程式KClO3+6HCl(浓)=KCl+3Cl2↑+3H2O可知,氧化剂为氯酸钾,还原剂为氯化氢,6mol氯化氢参加反应,做还原剂的氯化氢有5mol,所以该反应的氧化产物和还原产物的质量比为:5:1;
6.72L Cl2标况下氯气物质的量为$\frac{6.72L}{22.4L/mol}$=0.3mol,依据方程式可知生成3mol氯气转移5mol电子,则生成0.3mol电子转移电子数为:0.5NA;
故答案为: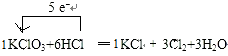 ;5:1; 0.5NA;
;5:1; 0.5NA;
(3)nBeO.Al2O3.6SiO2,根据O原子守恒得,n+3+6×2=18,所以n=3;根据硅酸盐改写成氧化物的形式为:活泼金属氧化物•较活泼金属氧化物•二氧化硅•水,同时要遵循原子守恒,Ca2Mg5Si8O22(OH)2可表示为:2CaO•5MgO•8SiO2•H2O;
故答案为:3;2CaO•5MgO•8SiO2•H2O.
点评 本题为综合题,考查了电解质、非电解质判断,氧化还原反应基本概念及电子转移数目计算,复杂化合物中原子个数的确定、复杂的硅酸盐改写成氧化物,题目综合性强,熟悉相关知识是解题关键,注意硅酸盐用氧化物来表示的方法及化合价原则.


科目:高中化学 来源: 题型:选择题
| A. | 向含少量Br2的CCl4中加NaOH溶液,充分振荡,上下两层均为无色 | |
| B. | 向pH试纸上滴加氯水,先变红后变白 | |
| C. | 将红热的铜丝伸入到盛有氯气的集气瓶中,产生蓝绿色的烟 | |
| D. | 往氯水中加入NaHCO3固体,有气体产生 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2.0 mol•L-1 | B. | 1.5 mol•L-1 | C. | 1 mol•L-1 | D. | 0.5 mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 弱碱性溶液中可能大量存在Na+、K+、Cl-、HCO3- | |
| B. | 滴加石蕊呈红色的溶液可能大量存在K+、NH4+、Cl-、S2- | |
| C. | 与Al反应能放出H2的溶液中可能大量存在:Fe2+、K+、NO3-、SO42- | |
| D. | 漂白粉的水溶液可能大量存在Fe2+、Cl-、Ca2+、Na+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 电解硫酸或酸式硫酸盐溶液,阳极反应为2SO42--2e-═S2O82- | |
| B. | S2O82-具有强氧化性,H2S2O8是二元强酸 | |
| C. | 减压蒸馏的目的是为了减少H2O2分解,蒸馏得到的另一组分可循环利用 | |
| D. | 由溶液A转化为溶液B发生了氧化还原反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2SO4 | B. | CH3COOH | C. | (NH4)2 SO4 | D. | NaOH |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | ①分离出BaSO4浊液中的BaSO4 | |
| B. | ②除去CO2中少量HCl气体 | |
| C. | ③配制一定物质的量浓度溶液时转移溶液 | |
| D. | ④制取一定量的CO2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com