
【题目】常温下,0.1 mol·L-1Na2S溶液中存在着水解平衡:S2-+H2O![]() HS-+OH-。下列说法正确的是( )
HS-+OH-。下列说法正确的是( )
A.加水稀释后恢复至常温,水解平衡正向移动,水解平衡常数增大
B.通入NH3,平衡正向移动
C.滴加少量AgNO3溶液,平衡逆向移动
D.升高温度,c(HS-)/c(S2-)减小
科目:高中化学 来源: 题型:
【题目】下列有关电解质溶液的说法正确的是
A.向0.1mol/LCH3COOH溶液中加入少量水,溶液中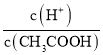 减小
减小
B.将CH3COONa溶液从20℃升温至30℃,溶液中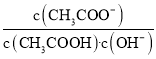 增大
增大
C.向盐酸中加入氨水至中性,溶液中c(NH4+):c(Cl-)>1
D.向AgCl、AgBr的饱和溶液中加入少量AgNO3,溶液中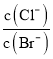 不变
不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 是原子序数依次增大的五种短周期元素,且
是原子序数依次增大的五种短周期元素,且![]() 是元素周期表中原子半径最小元素,
是元素周期表中原子半径最小元素,![]() 、
、![]() 相邻,
相邻,![]() 元素可以与
元素可以与![]() 、
、![]() 、
、![]() 元素分别形成甲、乙、丙三种物质,且甲、乙均为10电子化合物,丙为18电子双原子化合物。
元素分别形成甲、乙、丙三种物质,且甲、乙均为10电子化合物,丙为18电子双原子化合物。![]() 元素原子的最外层电子数与核外电子层数相等。已知:甲+丙→丁。下列说法正确的是
元素原子的最外层电子数与核外电子层数相等。已知:甲+丙→丁。下列说法正确的是
A.简单离子半径:![]()
B.![]() 与
与![]() 两种元素共同形成的10电子微粒有3种
两种元素共同形成的10电子微粒有3种
C.![]() 元素在元素周期表中的位置是第二周期第ⅡA族
元素在元素周期表中的位置是第二周期第ⅡA族
D.丁物质由非金属元素组成,只含共价键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在体积可变的密闭容器中发生可逆反应:2NO2(g)![]() 2NO(g)+O2(g)。能作为反应达到平衡状态的标志是
2NO(g)+O2(g)。能作为反应达到平衡状态的标志是
A.单位时间内生成n mol O2的同时生成n mol NO2
B.NO2、NO、O2三者的物质的量浓度之比为2:2:1
C.混合气体的密度不再改变
D.容器中气体压强不再变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在10 L密闭容器中,A、B、C三种气态物质构成了可逆反应的体系;当在某一温度时,A、B、C物质的量与时间的关系如图甲,C的百分含量与温度的关系如图乙。
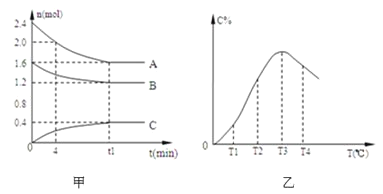
下列分析不正确的是( )
A.0~4 min时,A的平均反应速率为0.02 mol·L-1·min-1
B.该反应的化学方程式为2A(g)+B(g)C(g)
C.由T1向T2变化时,正反应速率大于逆反应速率
D.该反应正反应是放热反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下列图示所得出的结论正确的是
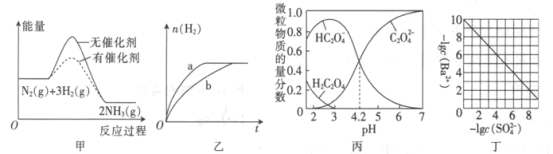
A.图甲表示.N2(g)+3H2(g)![]() 2NH3(g)反应过程的能量变化关系,说明催化剂可以改变该反应的焓变
2NH3(g)反应过程的能量变化关系,说明催化剂可以改变该反应的焓变
B.图乙表示等量的钠块分别与足量的水和乙醇反应产生氢气的物质的量随时间的变化关系,则曲线b表示水与钠的反应
C.图丙表示25℃时水溶液中H2C2O4、HC2O4-、C2O42-的物质的量分数随pH的分布,说明H2C2O4的Ka1=1×10-4.2
D.图丁表示25℃时BaSO4达到沉淀溶解平衡时,溶液中c(Ba2+)与c(SO42-)的关系曲线,说明Ksp(BaSO4)=1×10-10
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向20mLNaOH溶液中逐滴加入![]() 醋酸溶液,滴定曲线如图所示。下列判断正确的是
醋酸溶液,滴定曲线如图所示。下列判断正确的是
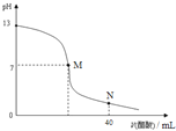
A.在M点,两者恰好反应完全
B.滴定前,酸中![]() 等于碱中
等于碱中![]()
C.NaOH溶液的物质的量浓度为![]()
![]()
D.在N点,c(CH3COO-)> c(Na+)>c(H+)> c(CH3COOH)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组数据中,前者刚好是后者两倍的是( )
A.2mol水的摩尔质量和1mol水的摩尔质量
B.20%NaOH溶液中NaOH的物质的量浓度和10%NaOH溶液中NaOH的物质的量浓度
C.64g二氧化硫中氧原子数和标准状况下22.4L一氧化碳中氧原子数g
D.200mL1mol/L氯化钙溶液中c(Cl-)和200mL1mol/L氯化钾溶液中c(Cl-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】多晶硅是制作光伏电池的关键材料。以下是由粗硅制备多晶硅的简易过程。
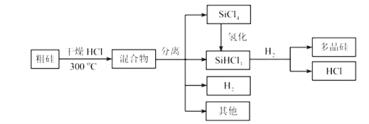
回答下列问题:
(I)硅粉与HCl在300℃时反应生成1mol SiHCl3气体和![]() ,放出225kJ热量,该反应的热化学方程式为________________________。
,放出225kJ热量,该反应的热化学方程式为________________________。![]() 的电子式为__________________。
的电子式为__________________。
(II)将![]() 氢化为
氢化为![]() 有三种方法,对应的反应依次为:
有三种方法,对应的反应依次为:
①SiCl4(g)+H2(g)![]() SiHCl3(g)+HCl(g)△H1>0
SiHCl3(g)+HCl(g)△H1>0
②3SiCl4(g)+2H2(g)+Si(s)![]() 4SiHCl3(g) △H2>0
4SiHCl3(g) △H2>0
③3SiCl4(g)+H2(g)+Si(s)+HCl(g)![]() 3SiHCl3△H3
3SiHCl3△H3
反应③的![]() ______(用△H1,△H2表示)。温度升高,反应③的平衡常数K______(填“增大”、“减小”或“不变”)。
______(用△H1,△H2表示)。温度升高,反应③的平衡常数K______(填“增大”、“减小”或“不变”)。
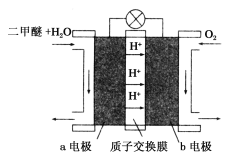
(III)如图为绿色电源“二甲醚(CH3OCH3)燃料电池”的工作原理示意图.b电极是________极。请写出负极的电极反应方程式:__________________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com