
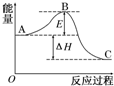
 2SO2(g)+O2(g)?2SO3(g)反应过程的能量变化如图所示.已知1mol SO2(g)氧化为1mol SO3的△H=-99 kJ•mol-1.请回答下列问题:
2SO2(g)+O2(g)?2SO3(g)反应过程的能量变化如图所示.已知1mol SO2(g)氧化为1mol SO3的△H=-99 kJ•mol-1.请回答下列问题:分析 (1)根据A、C、E分别表示反应物总能量、生成物总能量、正反应反应活化能;
(2)根据参加反应SO2的物质的量之比等于对应的△H之比;
(3)根据反应物和生成物确定反应的历程;
(4)反应速率之比等于化学计量数之比;
(5)根据单质硫的燃烧热以及1mol SO2(g)氧化为1mol SO3的反应热利用盖斯定律来计算.
解答 解:(1)因图中A、C、E分别表示反应物总能量、生成物总能量、正反应反应活化能,活化能大小影响反应的速率,但不影响反应的反应热,催化剂降低反应的活化能加快反应的速率,但不能改变反应热,
故答案为:反应物总能量;生成物总能量;没有影响;
(2)因1mol SO2(g)氧化为1mol SO3的△H=-99kJ•mol-1,所以2mol SO2(g)氧化为2mol SO3的△H=-198kJ•mol-1,
则2SO2(g)+O2(g)=2SO3(g)△H=-198kJ•mol-1,故答案为:-198kJ•mol-1;
(3)V2O5氧化SO2时,自身被还原为四价钒化合物;四价钒化合物再被氧气氧化,则反应的相关方程式为SO2+V2O5=SO3+2VO2;4VO2+O2=2V2O5,
故答案为:SO2+V2O5=SO3+2VO2;4VO2+O2=2V2O5;
(4)反应速率之比等于化学计量数之比,则υ(O2)=$\frac{1}{2}$υ(SO2)=$\frac{1}{2}$×0.05mol•L-1•min-1=0.025mol•L-1•min-1,υ(SO2)=υ(SO3)
故答案为:0.025;0.05;
(5)因单质硫的燃烧热为296kJ•mol-1,则S(s)+O2(g)=SO2(g)△H=-296kJ•mol-1,
而 1mol SO2(g)氧化为1mol SO3的△H=-99kJ•mol-1,则SO2(g)+$\frac{1}{2}$O2(g)=SO3(g)△H=-99kJ•mol-1,
由盖斯定律可得:S(s)+$\frac{3}{2}$O2(g)=SO3(g)△H=-296kJ•mol-1+(-99kJ•mol-1)=-395kJ•mol-1,
所以S(s)生成3mol SO3(g)的△H为-395kJ•mol-1×3=-1185 kJ•mol-1,
故答案为:因单质硫的燃烧热为296kJ•mol-1,则S(s)+O2(g)=SO2(g)△H=-296kJ•mol-1,
而 1mol SO2(g)氧化为1mol SO3的△H=-99kJ•mol-1,则SO2(g)+$\frac{1}{2}$O2(g)=SO3(g)△H=-99kJ•mol-1,
由盖斯定律可得:S(s)+$\frac{3}{2}$O2(g)=SO3(g)△H=-296kJ•mol-1+(-99kJ•mol-1)=-395kJ•mol-1,
所以S(s)生成3mol SO3(g)的△H为-395kJ•mol-1×3=-1185 kJ•mol-1.
点评 本题综合考查反应热与焓变,为高考常见题型,侧重于学生的分析能力和计算能力的考查,注意催化剂对反应的影响以及盖斯定律的应用.


科目:高中化学 来源: 题型:填空题
 .
. ;
;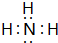 ,G的结构式为
,G的结构式为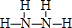 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硫酸钠的电离方程式:Na2SO4=Na2++SO42- | |
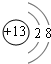
| B. | Mg2+的结构示意图: | |
| C. | 氮气的结构式::N≡N: | |
| D. | 氯化镁的电子式: |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 在原电池的负极和电解池的阴极上都发生失电子的氧化反应 | |
| B. | 电解是把电能转化成化学能 | |
| C. | 用惰性电极电解饱和NaCl溶液,若有1 mol电子转移,则生成1 mol NaOH | |
| D. | 钢铁发生电化学腐蚀时生成Fe3O4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | υ(A)=1.5 mol•L-1•s-1 | B. | υ(B)=0.5 mol•L-1•s-1 | ||
| C. | υ(C)=0.8 mol•L-1•s-1 | D. | υ(D)=1 mol•L-1•s-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 苯中溶有苯酚(浓溴水,过滤) | B. | 甲烷中含有乙烯(溴水,洗气) | ||
| C. | 乙醇中的乙酸(NaOH溶液,分液) | D. | 乙醇中含有水(金属钠,蒸馏) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③ | B. | ②③④ | C. | ②③⑥ | D. | ②⑤⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 正极反应为H2-2e-=2H+ | |
| B. | 在电池工作时,H+移向负极 | |
| C. | 电池正极发生氧化反应 | |
| D. | 以盐酸作为电解质溶液,并不断补充蒸馏水,以维持溶液一定的pH |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com