
| 0.1mol/L×0.02L×2 |
| 0.02L |
| 0.012mol |
| 0.02L |


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
| A、氢氟酸贮存在细口玻璃瓶里 |
| B、浓硫酸盛放在广口瓶里,应当用磨口玻璃塞,不能用橡皮塞 |
| C、盛溴的试剂瓶里加一些水来防止溴挥发 |
| D、少量碱金属单质都保存在煤油中;液氯贮存在钢瓶里 |
查看答案和解析>>
科目:高中化学 来源: 题型:
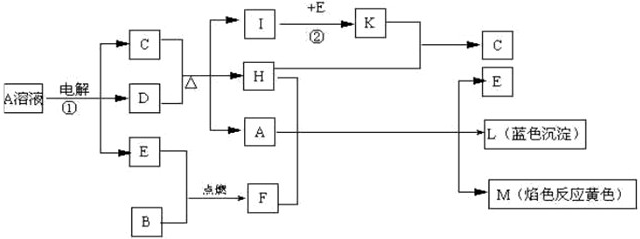
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| △ |
| 高温 |
| 高温 |
查看答案和解析>>
科目:高中化学 来源: 题型:
2- 4 |
| A、0.1mol?L-1 |
| B、0.15mol?L-1 |
| C、0.25mol?L-1 |
| D、0.5 mol?L-1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com