
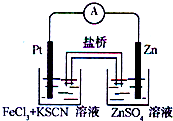
 实验发现,在FeCl3酸性溶液中加入少量锌粉后,Fe3+立即被还原成Fe2+.某化学兴趣小组根据该实验事实设计了如图所示的原电池装置.下列有关说法中正确的是( )
实验发现,在FeCl3酸性溶液中加入少量锌粉后,Fe3+立即被还原成Fe2+.某化学兴趣小组根据该实验事实设计了如图所示的原电池装置.下列有关说法中正确的是( )

科目:高中化学 来源:四川省雅安市2010-2011学年高一上学期期末考试化学试题 题型:022
小明很喜欢化学实验课,今天要学习“探究铁及其化合物的氧化性或还原性”.
(1)实验前小明预测说:
Fe2‘肯定既有还原性又有氧化性.你认为他预测的依据是:________(2)小明欲用实验证明他的预测.实验室提供了下列试剂:3%的
H2O2溶液、锌粒、铜片、0.1mol·Ll FeCl2溶液、KSCN溶液、新制氯水.①若小明计划在0.
1 mol·L1 FeCl2溶液滴入新制氯水,探究Fe.的还原性,你预计可能发生的反应和现象是:(写离子方程式)、溶液由浅绿色变________色.②实验中,小明发现现象不太明显,老师分析可能是产物的含量太低,建议可以通过检验
Fe2,被氧化的产物Fe3+的存在以获取证据.你认为可选________滴入小明所得的混合液中,并通过溶液出现________色的现象,证明小明的观点和实验方案都是正确的.③对于证明Fe2,具有氧化性,小明认为金属单质都具有还原性,并分别将铜片、锌粒投入
FeCL溶液中,结果铜片没变化,锌粒逐渐变小.由此说明三种金属的还原性由强至弱的顺序为________.(3)
小明分析H2O2中氧元素显-1价(中间价),并提出疑问:H2O2与FeCl2的反应时,Fe2t还作氧化剂吗?①请你为小明梳理相关问题:若Fe在反应中表现出氧化性应转化成________(填微粒符号,下同),若
Fe2t在反应中表现出还原性应转化成________.②实际上
Fe2+还原性较强,实验室的FeCl2溶液常因氧化而变质.除杂的方法是:________,相关反应的离子方程式:________.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com