
C、N、S是重要的非金属元素,按要求回答下列问题:
(1)烟道气中含有的CO和SO2是重要的污染物,可在催化剂作用下将它们转化为S(s)和CO2,此反应的热化学式为 .
已知:CO(g)+1/2O2(g)=CO2(g)△H=﹣283.0kJ•mol﹣1;S(s)+O2=SO2(g)△H=﹣296.0kJ•mol﹣1
(2)向甲、乙两个均为1L的密闭容器中,分别充入5mol SO2和3mol O2,发生反应:2SO2 (g)+O2 (g)⇌2SO3(g)△H<0.甲容器在温度为T1的条件下反应,达到平衡时SO3的物质的量为4.5mol;乙容器在温度为T2的条件下反应,达到平衡时SO3的物质的量为4.6mol.
则T1>T2(填“>”“<”),甲容器中反应的平衡常数K= .
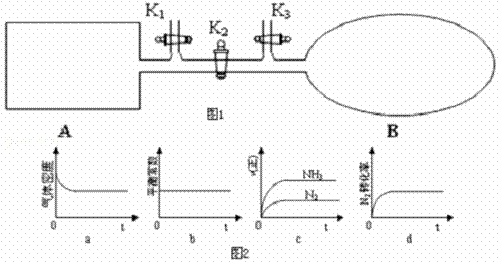
(3)如图1所示,A是恒容的密闭容器,B是一个体积可变的充气气囊.保持恒温,关闭K2,分别将1mol N2和3mol H2通过K1、K3充入A、B中,发生的反应为N2(g)+3H2(g)⇌2NH3(g),起始时A、B的体积相同均为a L.
①图2示意图中正确,且既能说明A容器中反应达到平衡状态,又能说明B容器中反应达到平衡状态的是d.
②容器A中反应到达平衡时所需时间t s,达到平衡后容器的压强变为原来的5/6,则平均反应速率v(H2)= .
(4)将0.1mol氨气分别通入1L pH=1的盐酸、硫酸和醋酸溶液中,完全反应后三溶液中NH4+离子浓度分别为c1、c2、c3,则三者浓度大小的关系为 (用c1、c2、c3和>、<、=表示).已知醋酸铵溶液呈中性,常温下CH3COOH的Ka=1×10﹣5 mol•L﹣1,则该温度下0.1mol•L﹣1的NH4Cl溶液的pH为 .
考点: 热化学方程式;化学平衡的影响因素;化学平衡的计算;弱电解质在水溶液中的电离平衡;盐类水解的应用.
分析: (1)已知①CO(g)+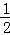 O2(g)=CO2(g)△H=﹣283.0KJ•mol﹣1
O2(g)=CO2(g)△H=﹣283.0KJ•mol﹣1
②S(s)+O2(g)=SO2(g)△H=﹣296.0KJ•mol﹣1
根据盖斯定律将方程式①×2﹣②得2CO(g)+SO2(g)=S(s)+2CO2(g),然后计算反应热;
(2)该反应为放热反应,温度越高,生成的SO3越少;先利用三段式求出平衡时各物质的浓度,再根据K=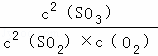 计算;
计算;
(3)①化学反应达到化学平衡状态时,正逆反应速率相等,且不等于0,各物质的浓度不再发生变化,由此衍生的一些物理量不发生变化,以此进行判断;
②已知反应为N2(g)+3H2(g)⇌2NH3(g),通入1mol N2和3mol H2,达到平衡后容器的压强变为原来的5/6,根据压强之比等于物质的量比结合三段式计算;
(4)pH=1的醋酸中醋酸的浓度大于0.1mol/L,则通入0.1mol氨气反应后,醋酸有剩余,醋酸电离的氢离子能抑制铵根离子的电离,氨气与硫酸和盐酸恰好反应;
醋酸铵溶液呈中性,则一水合氨和醋酸的电离常数相同,常温下CH3COOH的Ka=1×10﹣5 mol•L﹣1,所以NH3•H2O的电离常数为1×10﹣5 mol•L﹣1,Ka=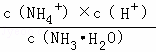 ,Kh=
,Kh=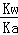 =1×10﹣9,据此计算.
=1×10﹣9,据此计算.
解答: 解:(1)①CO(g)+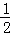 O2(g)=CO2(g)△H=﹣283.0KJ•mol﹣1
O2(g)=CO2(g)△H=﹣283.0KJ•mol﹣1
②S(s)+O2(g)=SO2(g)△H=﹣296.0KJ•mol﹣1
将方程式①×2﹣②得2CO(g)+SO2(g)=S(s)+2CO2(g)△H=(﹣283.0KJ•mol﹣1)×2﹣(﹣296.0KJ•mol﹣1)=﹣270KJ•mol﹣1,
所以热化学反应方程式为:2CO(g)+SO2(g)=S(s)+2CO2(g)△H=﹣270KJ•mol﹣1,
故答案为:2CO(g)+SO2(g)=S(s)+2CO2(g)△H=﹣270KJ•mol﹣1;
(2)该反应为放热反应,温度越高,生成的SO3越少,达到平衡时甲容器中生成的三氧化硫的物质的量少,则甲容器的温度高,即T1>T2;
2SO2 (g)+O2 (g)⇌2SO3(g)
起始(mol/L):5 3 0
转化(mol/L):x 0.5x x
平衡(mol/L):5﹣x 3﹣0.5x x
达到平衡时SO3的物质的量为4.5mol,则x=4.5mol/L,所以K=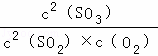 =
=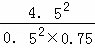 =108L•mol﹣1;
=108L•mol﹣1;
故答案为:>;108L•mol﹣1;
(3)①a.密度= ,总质量一定,A中体积不变,故密度不变,所以不能说明反应达到平衡状态,故a错误;
,总质量一定,A中体积不变,故密度不变,所以不能说明反应达到平衡状态,故a错误;
b.恒温条件下,平衡常数保持不变,则不能说明反应达到平衡状态,故b错误;
c.都是正反应速率,不能说明反应达到平衡状态,故c错误;
d.N2的转化率先增大,后保持不变,说明反应达到平衡状态,与图象相符,故d正确;
故答案为:d;
②
N2(g)+3H2(g)⇌2NH3(g)
起始(mol):1 3 0
转化(mol):x 3x 2x
平衡(mol):1﹣x 3﹣3x 2x
达到平衡后容器的压强变为原来的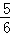 ,则
,则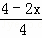 =
=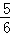 ,解得x=
,解得x=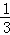 ,
,
v(H2)=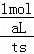 =
=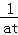 mol•L﹣1•S﹣1;
mol•L﹣1•S﹣1;
故答案为: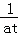 mol•L﹣1•S﹣1;
mol•L﹣1•S﹣1;
(4)pH=1的醋酸中醋酸的浓度大于0.1mol/L,则通入0.1mol氨气反应后,醋酸有剩余,醋酸电离的氢离子能抑制铵根离子的电离,铵根离子浓度较大,氨气与硫酸和盐酸恰好反应,所以溶液中铵根离子浓度:c1=c2<c3,;
醋酸铵溶液呈中性,则一水合氨和醋酸的电离常数相同,常温下CH3COOH的Ka=1×10﹣5 mol•L﹣1,所以NH3•H2O的电离常数为1×10﹣5 mol•L﹣1,
Ka=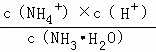 =1×10﹣5,Kh=
=1×10﹣5,Kh=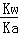 =1×10﹣9,
=1×10﹣9,
设c(H+)为xmol/L,
则Kh=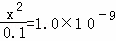 ,解得x=1×10﹣5mol/L,所以pH=5;
,解得x=1×10﹣5mol/L,所以pH=5;
故答案为:c1=c2<c3;5.
点评: 本题考查较综合,涉及平衡常数计算、反应速率计算、平衡状态判断、弱电解质的电离等知识点,这些都是2015届高考高频点,侧重考查学生分析、计算及知识运用能力,注意只有反应前后改变的物理量才能作为平衡状态的判断依据,注意化学平衡常数计算中用物质浓度而不是物质的量计算,这些都是易错点.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
将铝粉与某铁的氧化物FeO•2Fe2O3粉末配制成铝热剂,分成两等份.一份直接放入足量的烧碱溶液中,充分反应后放出气体在标准状况下的体积为15.68L;另一份在高温下恰好反应完全,反应后的混合物与足量的盐酸反应后,放出的气体在标准状况下的体积为()
A. 11.20L B. 15.68L C. 22.40L D. 31.36L
查看答案和解析>>
科目:高中化学 来源: 题型:
下列措施或事实不能用勒夏特列原理解释的是()
A. 新制的氯水在光照下颜色变浅
B. Fe(SCN)3溶液中加入6mol/L NaOH溶液后颜色变浅
C. 在合成氨的反应中,降温或加压有利于氨的合成
D. H2、I2、HI平衡混合气加压后颜色变深
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关实验的说法不正确的是()
A. 在测定中和反应的反应热实验中,要读取最高温度
B. 中和滴定实验中,洗净后的锥形瓶不需要干燥
C. 向CH3COONa溶液中滴入石蕊试液,溶液变蓝
D. 向白色ZnS沉淀上滴加CuSO4溶液,沉淀变为黑色,说明Ksp(ZnS)<Ksp(CuS)
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)如图是由4个碳原子结合成的6种有机物(氢原子没有画出):
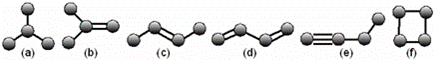
①写出有机物(a)的系统命名法的名称 ;
②上述有机物中与(c)互为同分异构体的是 (填序号);
③任写一种与(e)互为同系物的有机物的结构简式 ;
④上述有机物中不能与溴水反应使其褪色的有 (填序号).
(2)某有机物含C、H、O、N四种元素,质量分数分别为32%、6.66%、42.67%、18.67%.该有机物的蒸汽对氢气的相对密度为37.5.通过计算确定:
①该有机物的分子式 ;
②写出该有机物可能的一种同分异构体的结构简式 、.
查看答案和解析>>
科目:高中化学 来源:2015-2016学年黑龙江省高二上期末化学试卷(解析版) 题型:选择题
25℃时下列说法正确的是
A.在pH=12的溶液中由水提供的c(OH-)一定是10-12 mol·L-1
B.将pH=2的酸溶液和pH=12的碱溶液等体积混合后溶液的pH=7
C.将pH=6和pH=4的两种盐酸等体积混合后其c(OH-)接近0.5×(10-8+10-10) mol·L-1
D.Na2CO3溶液中:c(Na+) >c(CO32-)>c(OH-)>c(HCO3-)>c(H+)
>c(CO32-)>c(OH-)>c(HCO3-)>c(H+)
查看答案和解析>>
科目:高中化学 来源:2015-2016学年内蒙古巴彦淖尔一中高一上期中化学试卷(解析版) 题型:选择题
下列各组离子在水溶液中能大量共存的是
A.Ca2+、K+、CO32-、Cl- B.Ba2+、Na+、SO42-、NO3-
C.Ca2+、Na+、NO3-、Cl- D.H+、Na+、OH-、Cl-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com