
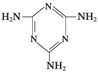
 俗称“蛋白精”。动物摄入三聚氰胺和三聚氰酸
俗称“蛋白精”。动物摄入三聚氰胺和三聚氰酸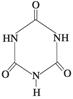 后,
后,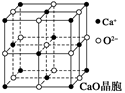
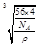 (3分)
(3分)

科目:高中化学 来源:不详 题型:单选题
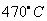 、80MPa下合成出金刚石,具有深远意义。下列说法不正确的是
、80MPa下合成出金刚石,具有深远意义。下列说法不正确的是| A.由二氧化碳合成金刚石是化学变化 | B.金刚石和石墨互为同位素 |
| C.钠被氧化最终生成碳酸钠 | D.金刚石属于原子晶体 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.晶体熔点由低到高:CF4<CCl4<CBr4<CI4 | B.硬度由大到小:金刚石>碳化硅>晶体硅 |
| C.熔点由高到低:Na>Mg>Al | D.晶格能由大到小:NaF> NaCl> NaBr>NaI |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.氯化铝是电解质 | B.固体氯化铝是分子晶体 |
| C.可用电解熔融氯化铝的办法制取金属铝 | D.氯化铝为非极性分子 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
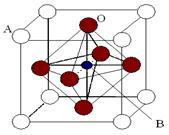
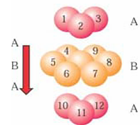
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.C3N4晶体是分子晶体 |
| B.C3N4晶体中,C-N键的键长比金刚石中的C-C键的键长要长 |
| C.C3N4晶体中每个C原子连接4个N原子,而每个N原子连接3个C原子 |
| D.C3N4晶体中微粒间通过离子键结合 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.在氯化钠晶体中,每个Na+周围有6个Cl-,形成离子晶体 |
| B.在氯化钠晶体中存在NaCl分子 |
| C.石英是由SiO2形成的分子晶体 |
| D.金刚石和石墨晶体都是由碳原子形成的网状结构,是典型的原子晶体 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.①②③ | B.②③④ | C.④⑤⑥ | D.②③⑦ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
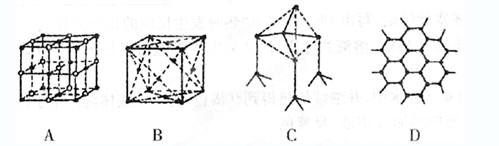
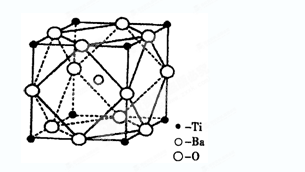
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com