
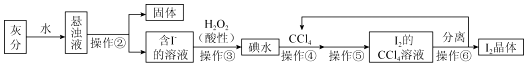
分析 流程分析可知,灰分加水溶解浸泡后过滤的含I-的溶液,加入酸性过氧化氢氧化得到碘水,加入四氯化碳萃取后分液、分离得到碘晶体,四氯化碳循环使用,
(1)分析流程可知操作②是分离固体和液体,操作⑤是分离互不相溶的液体用萃取分液方法分离;
(2)萃取分液选取不溶于水的有机溶剂,碘单质在其中溶解度大于水中且不与碘水反应;
(3)①用NaOH浓溶液反萃取后再加稀酸,可以分离I2和CCl4,向装有I2的CCl4溶液的分液漏斗中加入氢氧化钠溶液正当进行反萃取;
②振荡至溶液紫红色消失,碘单质和氢氧化钠反应,静置分层,四氯化碳密度 大在下层;
③含碘的碱溶液从分液漏斗上口倒出;
法二:分离I2和CCl4用蒸馏方法,
(4)参与实验过程,最后重新生成的物质可以循环使用;
(5)操作③反应是过氧化氢氧化碘离子生成碘单质;
解答 解:流程分析可知,灰分加水溶解浸泡后过滤的含I-的溶液,加入过氧化氢氧化得到碘水,加入四氯化碳萃取后分液、分离得到碘晶体,四氯化碳循环使用;
(1)分析流程可知操作②是分离固体和液体,实验操作为过滤,操作⑤是分离互不相溶的液体用分液方法分离,实验操作为萃取分液,
故答案为:过滤;萃取分液;
(2)操作④选用CCl4的理由是CCl4不溶于水,CCl4的密度与水不同,碘在CCl4中比在水中溶解度更大,CCl4与碘水不反应,
故答案为:ABCD;
(3)法一:用NaOH浓溶液与溶解在CCl4中的I2反应,分液后再加稀硫酸使I2晶体析出
①用NaOH浓溶液反萃取后再加稀酸,可以分离I2和CCl4,向装有I2的CCl4溶液的分液漏斗中加入氢氧化钠溶液正当进行反萃取;
故答案为:分液漏斗;
②振荡碘单质和氢氧化钠反应,至溶液紫红色消失,静置分层,四氯化碳密度大在分液漏斗的下层,从下层放出,
故答案为:紫红;下;
③含碘的碱溶液从分液漏斗上口倒出,故答案为:上;
法二:可用蒸馏法分离I2和CCl4,故答案为:蒸馏;
(4)参与实验过程,最后重新生成的物质可以循环使用,流程分析可知四氯化碳可以循环使用,故答案为:CCl4 ;
(5)操作③反应是过氧化氢酸性溶液中氧化碘离子生成碘单质,反应的离子方程式为:H2O2+2I-+2H+=I2+2H2O,反应为氧化还原反应,
故答案为:H2O2+2I-+2H+=I2+2H2O;氧化还原.
点评 本题考查了流程分析,混合物分离方法和提纯的实验过程分析,掌握基础是关键,题目难度中等.


 一线名师提优试卷系列答案
一线名师提优试卷系列答案 阳光试卷单元测试卷系列答案
阳光试卷单元测试卷系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③④⑤ | B. | ②③④⑤ | C. | ①③④ | D. | ①②④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用氨水吸收过量的二氧化硫:NH3•H2O+SO2═HSO3-+NH4+ | |
| B. | 用过氧化氢从酸化的海带灰浸出液中提取碘:2I-+H2O2+2H+═I2+2H2O | |
| C. | 向NH4Al(SO4)2溶液中滴入Ba(OH)2溶液恰好使SO42-完全沉淀:2Ba2++Al3++2SO42-+4OH-═AlO2-+2BaSO4↓+2H2O | |
| D. | 向含0.1mol•L-1Na2CO3和0.2mol•L-1NaOH的混合溶液中加入等体积的0.15mol•L-1的硫酸:CO32-+3H++2OH-═2H2O+HCO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | -(a+$\frac{b}{2}$+c)kJ/mol | B. | +(a+$\frac{b}{2}$+c)kJ/mol | C. | -(2a+b+2c)kJ/mol | D. | +(2a+b+2c)kJ/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 组号 | 反应温度 /℃ | 参加反应物质 | ||||
| KMnO4 | H2C2O4 | MnSO4 | ||||
| V/mL | c/mol•L-1 | V/mL | c/mol•L-1 | m/g | ||
| A | 20 | 4 | 0.1 | 2 | 0.1 | 0 |
| B | 20 | 4 | 0.1 | 2 | 0.1 | 0.1 |
| C | 40 | 4 | 0.1 | 2 | 0.1 | 0 |
| D | 40 | 4 | 0.1 | 2 | 0.2 | 0.1 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HCl、H2SO4、NaOH | B. | NaOH、HCl、H2SO4 | ||
| C. | HCl、H2SO4、NH3•H2O | D. | HCl、NH3•H2O、H2SO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com