
| A. | 氟化氢的电子式: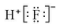 | |
| B. | 氯原子的结构示意图: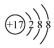 | |
| C. | 丙烯的结构简式:C3H6 | |
| D. | 硫原子的最外层电子排布式:3s23p4 |
 愉快的寒假南京出版社系列答案
愉快的寒假南京出版社系列答案科目:高中化学 来源: 题型:解答题
| 弱酸 | CH3COOH | H2CO3 | HNO2 |
| 电离常数 | K=1.8×10-5 | K=4.3×10-7 K=5.6×10-11 | K=5.0×10-4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 100 mL 0.2 mol•L-1蔗糖溶液中所含分子总数为0.02NA | |
| B. | 40mL 10mol•L-1的浓盐酸与足量的MnO2充分反应,生成氯气的分子数为0.1NA | |
| C. | 标准状况下,22.4L CHCl3中含有的氯原子数目为3NA | |
| D. | 14g CO 和N2混合气体中含有的电子总数为7NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
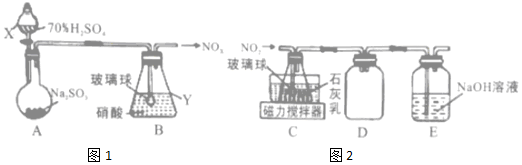
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
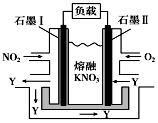 某燃料电池的工作原理如右图所示,该电池在使用过程中石墨Ⅰ电极上生成氧化物Y,Y可循环使用.下列说法正确的是( )
某燃料电池的工作原理如右图所示,该电池在使用过程中石墨Ⅰ电极上生成氧化物Y,Y可循环使用.下列说法正确的是( )| A. | 该电池放电时K+向石墨Ⅰ电极迁移 | |
| B. | 石墨Ⅰ附近发生的反应:NO2-e-+NO3-═N2O5 | |
| C. | O2在石墨Ⅱ附近发生氧化反应,Y为NO | |
| D. | 相同条件下,放电过程中消耗的NO2和O2的体积比为2:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
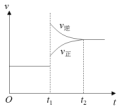 如图是工业合成氨反应的速率-时间图象,在 t1时刻改变某一条件,到 t2时重新达到平衡,判断 t1时刻可能改变条件是( )
如图是工业合成氨反应的速率-时间图象,在 t1时刻改变某一条件,到 t2时重新达到平衡,判断 t1时刻可能改变条件是( )| A. | 使用催化剂 | B. | 升高温度 | C. | 增大压强 | D. | 提高 N2浓度 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
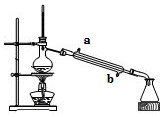
| A. | 蒸馏烧瓶中加入沸石的作用是防止暴沸 | |
| B. | 实验时冷却水应从a进入,从b流出 | |
| C. | 锥形瓶中能收集到高浓度的氯化钠溶液 | |
| D. | 该装置可用于分离海水中的NaCl和MgCl2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 在100℃时,将0.100mol的四氧化二氨气体充入1L恒容抽空的密闭容器中,隔一定时间对该容器内的物质浓度进行分析得到表数据:
在100℃时,将0.100mol的四氧化二氨气体充入1L恒容抽空的密闭容器中,隔一定时间对该容器内的物质浓度进行分析得到表数据:| 时间(s) | 0 | 20 | 40 | 60 | 80 |
| c(N2O4)/mol•L-1 | 0.100 | c1 | 0.050 | 0.040 | 0.040 |
| c(NO2)/mol•L-1 | 0.000 | 0.060 | c2 | 0.120 | 0.120 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com