
【题目】信息时代产生的大量电子垃圾对环境构成了极大的威胁。某“变废为宝”学生探究小组将一批废弃的线路板简单处理后,得到含70%Cu、25%Al、4%Fe 及少量Au、Pt 的合金,并设计出由合金制备硫酸铜和硫酸铝晶体的路线:
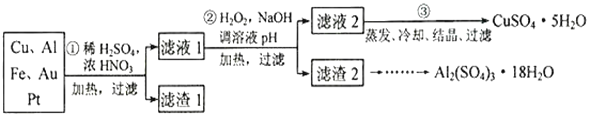
请回答下列向题:
(1)第①步Cu与酸反应的离子方程式___________________,得到滤渣1的主要成分为_________。
(2)第②步加H2O2的作用是做氧化剂,将溶液中的Fe2+离子氧化为Fe3+,写出该反应的离子方程式_______________________________,用H2O2做氧化的优点是__________________。
(3)滤渣2的主要成分中Al(OH)3和Fe(OH)3在生产中如何分离两种沉淀,写出反应的离子方程式:_____________________________________________。
【答案】Cu+4H++2NO3-=Cu2++2NO2↑+2H2O Au、Pt 2Fe2++H2O2+2H+=2Fe3++2H2O 不引入新的杂质,对环境无污染 Al(OH)3+OH-=AlO2-+2H2O
【解析】
稀硫酸、浓硝酸混合后加热,Cu、Al、Fe发生反应生成Cu2+、Al3+、Fe2+,滤渣1的成分是Pt和Au,滤液1中的金属离子是Cu2+、Al3+、Fe2+;过氧化氢具有氧化性,可以氧化亚铁离子为铁离子易于沉淀除去,调节溶液pH目的是铁离子和铝离子全部沉淀,滤渣2的成分为氢氧化铁和氢氧化铝,据此分析解答。
(1)稀硫酸、浓硝酸混合后加热,Cu、Al、Fe发生反应生成Cu2+、Al3+、Fe2+,因此第①步Cu与酸反应的离子方程式为Cu+4H++2NO3-=Cu2++2NO2↑+2H2O;Au、Pt不能溶于混酸中,则得到滤渣1的主要成分为Au、Pt;
(2)第②步加H2O2的作用是将Fe2+氧化为Fe3+,反应的离子方程式为2Fe2++H2O2+2H+=2Fe3++2H2O;过氧化氢做氧化剂还原产物是水,不引入杂质,对环境无污染;
(3)氢氧化铝是两性氢氧化物,则可以用氢氧化钠溶液把Al(OH)3和Fe(OH)3分离,该反应的离子方程式为Al(OH)3+OH-=AlO2-+2H2O。


科目:高中化学 来源: 题型:
【题目】下列实验不能达到目的的是
A.用NaOH溶液除去镁粉中的铝粉
B.将Na2O2投入到FeCl2溶液中制备氢氧化铁
C.用盐酸和AgNO3溶液鉴定Cl-
D.用加热的方法鉴别Na2CO3和NaHCO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学用10mol/L的浓盐酸配制230mL1mol/L的稀盐酸,并进行有关实验。请回答下列问题:
(1)需要量取浓盐酸___________mL。
(2)配制该稀盐酸时使用的仪器除量筒、烧杯、玻璃棒外,还必须用到的仪器有______、______等。
(3)若实验遇下列情况,溶液的物质的量浓度是: ①偏高 ②偏低 ③不变
A、加水定容时越过刻度线_________(填序号)。
B、忘记将洗涤液转入容量瓶__________(填序号)。
C、容量瓶内壁附有水珠而未干燥处理__________ (填序号)。
D、量取的浓盐酸置于烧杯中较长时间后配制__________ (填序号)。
(4)取所配制的稀盐酸100mL,与一定质量的锌充分反应,若锌全部溶解后,生成的气体在标准状况下的体积为0.896L,则参加反应的锌的质量为______g,设反应后溶液的体积仍为100mL,则反应后溶液中H+的物质的量浓度为_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列陈述I、Ⅱ正确并且有因果关系的是 ( )
选项 | 表述I | 表述II |
A | SO2有漂白性 | SO2可使溴水褪色 |
B | ClO2有强氧化性 | ClO2可用于自来水消毒 |
C | 常温下铁与浓硫酸不反应 | 可用铁槽车密封运送浓硫酸 |
D | NH3·H2O具有碱性 | NH3可使干燥的蓝色石蕊试纸变红 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关物质用途的说法正确的是()
A. 二氧化硅是生产光纤制品的基本原料
B. 水玻璃可用于生产黏合剂和防火剂
C. 高锰酸钾可用于医药上消毒剂
D. 碳酸钠可用于洗涤剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】若原子的最外层电子排布为ns1的元素R的叙述正确的是
A. 一定是ⅠA族元素
B. 一定是金属元素
C. 可能不是金属元素也可能是非金属元素
D. 不是ⅡA族元素就是副族元素
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知反应A+B=C+D的能量变化如图所示(E1、E2均为正值),下列说法正确的是
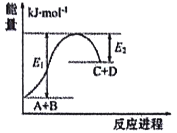
A. 破坏反应物中的化学键所吸收的能量小于形成生成物中化学键所放出的能量
B. 该反应只有在加热条件下才能进行
C. A和B的总能量一定高于C和D的总能量
D. 该反应吸收的能量为(E1-E2)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将一小块金属钠投入到硫酸铜溶液中,最终得到的主要产物有 :( )
A. Cu和Na2SO4 B. Cu(OH)2 、Na2SO4和H2
C. Cu、Na2SO4和 H2 D. Cu、Cu(OH)2 、Na2SO4和 H2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将下图所示实验装置的 K 闭合,下列判断正确的是
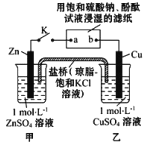
A.片刻后甲池中 c(SO42-)增大 B.电子沿 Zn→a→b→Cu 路径流动
C.Cu 电极上发生还原反应 D.片刻后可观察到滤纸 b 点变红色
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com