
| A. | 粗铜在阳极的反应顺序是:Fe-2e-═Fe2+、Ni-2e-═Ni2+、Cu-2e-═Cu2+,杂质金和银不反应形成“阳极泥” | |
| B. | 电解一段时间后,溶液中Cu2+减小 | |
| C. | 若电路中通过1 mol电子,阳极有0.5 mol铜被氧化 | |
| D. | 阴极反应只有Cu2++2e-═Cu |
分析 A.还原性越强,优先失去电子,根据还原性Fe>Ni>Cu>Fe2+进行判断;
B.阴极上溶液中的铜离子得到电子发生还原反应在阴极析出;
C.粗铜中含有铁、镍等活泼性强于铜的金属,先于铜放电;
D.阴极上溶液中的铜离子得到电子发生还原反应.
解答 解:A.由于还原性还原性Fe>Ni>Cu>Fe2+,则粗铜在阳极的反应顺序是:Fe-2e-→Fe2+、Ni-2e-→Ni2+、Cu-2e-→Cu2+,所以杂质金和银不反应形成“阳极泥”,故A正确;
B.溶液中的铜离子在阴极得到电子发生还原反应析出,所以铜离子浓度降低,故B正确;
C.粗铜中含有铁、镍等活泼性强于铜的金属,先于铜放电,所以若电路中通过1 mol电子,被氧化的铜的物质的量小于0.5 mol,故C错误;
D.阴极上溶液中的铜离子得到电子发生还原反应,电极反应式为:Cu2++2e-→Cu,故D正确;
故选C.
点评 本题考查了电解原理及其应用,题目难度中等,熟悉电解池工作原理是解题关键,注意明确阳极放电顺序,试题侧重基础知识的考查,培养了学生的灵活应用能力.


 智趣寒假作业云南科技出版社系列答案
智趣寒假作业云南科技出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | 在常温常压下,11.2LO2含有的分子数为0.5NA | |
| B. | 在常温常压下,1mol氦气含有的原子数为2NA | |
| C. | 71gCl2所含原子数为2NA | |
| D. | 标准状况下,1molH2O和1 molH2的体积都约为22.4L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | ① | ② | ③ | 实验结论 |  |
| A | 稀硫酸 | Na2S | AgNO3与 AgCl的浊液 | Ksp(AgCl)>Ksp(Ag2S) | |
| B | 浓盐酸 | MnO2 | NaBr溶液 | 氧化性:MnO2>Cl2>Br2 | |
| C | 浓硫酸 | 蔗糖 | 溴水 | 浓硫酸具有脱水性、氧化性 | |
| D | 浓硝酸 | Na2CO3 | Na2SiO3溶液 | 酸性:硝酸>碳酸>硅酸 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 漂粉精的主要成分:CaCl2 | |
| B. | 乙烯的结构简式:CH2=CH2 | |
| C. | Na+的结构示意图: | |
| D. | 原子核内有10个中子的氧原子:${\;}_{8}^{18}$O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 某温度(t℃)下的溶液中,c(H+)=10-xmol•L-1,c(OH-)=10-ymol•L-1,x与y的关系如图所示.请回答下列问题:
某温度(t℃)下的溶液中,c(H+)=10-xmol•L-1,c(OH-)=10-ymol•L-1,x与y的关系如图所示.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | b+Q-a kJ/mol | B. | 2b-Q-a kJ/mol | C. | 2b+Q-a kJ/mol | D. | b-Q+a kJ/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
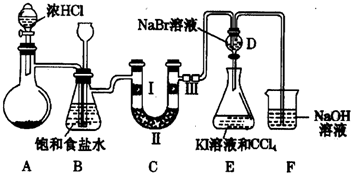
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 萃取操作可在普通漏斗中完成 | |
| B. | 浓烧碱液沾到皮肤上应立即用稀盐酸冲洗 | |
| C. | 用酒精灯加热试管内液体时一定要先给试管预热再集中加热液体部位 | |
| D. | 用托盘天平称出25.20g氯化钠 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com