
固体A在一定温度下分解生成气体B、C、D:2A=B+2C+3D
若测得生成气体的质量是相同体积的![]() 的15倍,则固体A的摩尔质量是
的15倍,则固体A的摩尔质量是
[ ]
 津桥教育计算小状元系列答案
津桥教育计算小状元系列答案科目:高中化学 来源:2013届江苏省盐城市明达中学高三上学期学情调研考试化学试卷(带解析) 题型:填空题
(10 分)用氮化硅(Si3N4)陶瓷代替金属制造发动机的耐热部件,能大幅度提高发动机的热效率。工业上用化学气相沉积法制备氮化硅,其反应如下:
3SiCl4(g) + 2N2(g) + 6H2(g) Si3N4(s) + 12HCl(g) △H<0
Si3N4(s) + 12HCl(g) △H<0
(1)在一定温度下进行上述反应,若反应容器的容积为2L,3min后达到平衡,测得固体的质量增加了1.40g,则SiCl4的平均反应速率为 ;该反应的平衡常数表达式为 。
(2)上述反应达到平衡后,下列说法正确的是
a.其他条件不变,温度升高,平衡常数K减小
b.其他条件不变,压强增大,平衡向正反应方向移动
c.其他条件不变,增大SiCl4物质的量,平衡向正反应方向移动
d.其他条件不变,增大Si3N4物质的量,平衡向逆反应方向移动
(3)一定条件下,在密闭恒容的容器中,能表示上述反应达到化学平衡状态的是
a.v逆(N2)=3v正(H2) b.v正(HCl)=4v逆(SiCl4)
c.混合气体密度保持不变 d.c(N2):c(H2):c(HCl)=1:3:6
(4)若平衡时H2和HCl的物质的量之比为m/n,保持其他条件不变,降低温度后达到新德平衡时,H2和HCl的物质的量之比 m/n(填“>”“=”或“<”)
查看答案和解析>>
科目:高中化学 来源:2011-2012学年陕西省师大附中高一下学期期末考试化学试卷(带解析) 题型:填空题
(9分)在一定温度下,向一个容积不变的容器中加入3 mol SO2和2 mol O2及固体催化剂,发生反应:2SO2(g)+O2(g)=2SO3(g)ΔH=-196.6 kJ/mol,平衡时容器内气体压强为起始时的90%。
(1)加入3mol SO2和3mol O2发生反应,达到平衡时,SO2的转化率为_____。
(2)保持温度不变,在相同的容器中,将起始物质的物质的量改为a mol SO2、b mol O2、c mol SO3(g)(c>0),欲使平衡时SO3的体积分数为2/9,O2的体积分数为3/9,则:
①达到平衡时,(1)与(2)放出的热量________(填序号)。
| A.相等 | B.前者小于后者 | C.前者大于后者 | D.无法确定 |
查看答案和解析>>
科目:高中化学 来源:2011-2012学年湖北省武汉市四校高二上学期期中考试化学试卷(带解析) 题型:计算题
(12分)在一定温度下,向容积不变的容器中加入2 mol N2、8 mol H2及固体催化剂,使之反应。已知:N2(g)+3H2(g)  2NH3(g) ΔH=-92.2 kJ· mol-1。平衡时,容器内气体压强为起始时的80%。
2NH3(g) ΔH=-92.2 kJ· mol-1。平衡时,容器内气体压强为起始时的80%。
(1)反应达到平衡时,放出的热量 ( )
A.小于92.2 kJ B.等于92.2 kJ C.大于92.2 kJ
(2)保持同一温度,在相同的容器中,若起始时加入2 mol NH3、1 mol H2及固体催化剂,反应达到平衡时NH3的体积分数 ( )
A.等于0.25 B.大于0.25 C.小于0.25
(3)保持同一温度,在相同的容器中,起始通入一定物质的量N2、H2、NH3,欲使平衡时NH3的体积分数一定等于0.25。且起始时向正反应方向进行,则充入N2的物质的量a mol的取值范围是_________________________________________。
(4)如图是T1℃时容器中NH3的物质的量随时间的变化曲线,请在该图中补画出该反应在T2℃(T2>T1)时n(NH3)的变化曲线。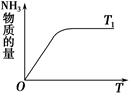
查看答案和解析>>
科目:高中化学 来源:2012-2013学年江苏省盐城市高三上学期学情调研考试化学试卷(解析版) 题型:填空题
(10 分)用氮化硅(Si3N4)陶瓷代替金属制造发动机的耐热部件,能大幅度提高发动机的热效率。工业上用化学气相沉积法制备氮化硅,其反应如下:
3SiCl4(g) + 2N2(g) + 6H2(g)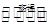 Si3N4(s) +
12HCl(g) △H<0
Si3N4(s) +
12HCl(g) △H<0
(1)在一定温度下进行上述反应,若反应容器的容积为2L,3min后达到平衡,测得固体的质量增加了1.40g,则SiCl4的平均反应速率为 ;该反应的平衡常数表达式为 。
(2)上述反应达到平衡后,下列说法正确的是
a.其他条件不变,温度升高,平衡常数K减小
b.其他条件不变,压强增大,平衡向正反应方向移动
c.其他条件不变,增大SiCl4物质的量,平衡向正反应方向移动
d.其他条件不变,增大Si3N4物质的量,平衡向逆反应方向移动
(3)一定条件下,在密闭恒容的容器中,能表示上述反应达到化学平衡状态的是
a.v逆(N2)=3v正(H2) b.v正(HCl)=4v逆(SiCl4)
c.混合气体密度保持不变 d.c(N2):c(H2):c(HCl)=1:3:6
(4)若平衡时H2和HCl的物质的量之比为m/n,保持其他条件不变,降低温度后达到新德平衡时,H2和HCl的物质的量之比 m/n(填“>”“=”或“<”)
查看答案和解析>>
科目:高中化学 来源:2014届陕西省高一下学期期末考试化学试卷(解析版) 题型:填空题
(9分)在一定温度下,向一个容积不变的容器中加入3 mol SO2和2 mol O2及固体催化剂,发生反应: 2SO2(g)+O2(g)=2SO3(g) ΔH=-196.6 kJ/mol,平衡时容器内气体压强为起始时的90%。
(1)加入3mol SO2和3mol O2发生反应,达到平衡时,SO2的转化率为_____。
(2)保持温度不变,在相同的容器中,将起始物质的物质的量改为a mol SO2、b mol O2、c mol SO3(g)(c>0),欲使平衡时SO3的体积分数为2/9,O2的体积分数为3/9,则:
①达到平衡时,(1)与(2)放出的热量________(填序号)。
A.相等 B.前者小于后者 C.前者大于后者 D.无法确定
②a.b.c必需满足的关系是(一个用a.c表示,另一个用b.c表示):__ _。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com