
【题目】我国每年产生的废旧铅蓄电池约330万吨。从含铅废料(含PbSO4、PbO2、PbO等)中回收铅,实现铅的再生,意义重大。一种回收铅的工艺流程如下:
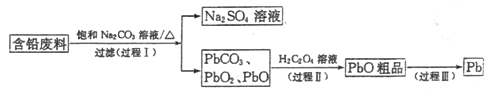
(1)铅蓄电池放电时,PbO2作____极。
(2)过程I,已知:PbSO4、PbCO3的溶解度(20℃)见图l;Na2SO4、Na2CO3的溶解度见如图。
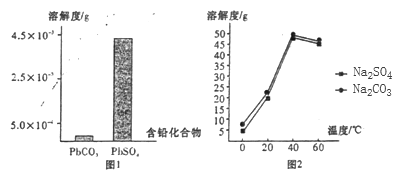
①根据图l写出过程I的离子方程式:__________。
②生产过程中的温度应保持在40℃,若温度降低,PbSO4的转化速率下降。根据如图,解释可能原因:
i.温度降低,反应速率降低; ii.______________(请你提出一种合理解释)。
(3)①过程Ⅱ,发生反应2PbO2+H2C2O4=2PbO+H2O2+2CO2↑。实验中检测到有大量O2放出,推测PbO2氧化了H2O2,通过实验证实了这一推测。实验方案是___________。
(已知:PbO2为棕黑色固体;PbO为橙黄色固体)
②写出H2O2的电子式__________。
(4)过程Ⅲ,将PbO粗品溶解在HCl和NaCl的混合溶液中,得到含Na2PbCl4的电解液,电解Na2PbCl4溶液,生成Pb,如图。
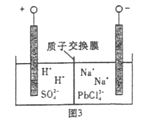
①阴极的电极反应式是____________。
②电解一段时间后,PbCl42-浓度极大下降,为了恢复其浓度且实现物质的循环利用,阴极区采取的方法是_______。
(5)如果用铅蓄电池作电源电解饱和食盐水制取Cl2,已知某铅蓄电池中硫酸溶液的体积为0.8L,电解其按硫酸浓度为4.5mol/L,当制得26.88L Cl2时(指在标准状况下),求理论上电解后电池中硫酸溶液的浓度为________ mol·L-1。(假设电解前后硫酸溶液的体积不变)
【答案】 正 PbSO4(s)+CO32-(aq)=PbCO3(s)+SO42-(aq) Na2CO3浓度降低,反应速率降低 取少量PbO2与试管中,向其中滴加H2O2溶液,产生可使带火星木条复燃的气体,同时棕黑色固体变为橙黄色,证实推测正确 ![]() PbCl42-+2e-=Pb+4Cl- 继续向阴极区加PbO粗品 1.5
PbCl42-+2e-=Pb+4Cl- 继续向阴极区加PbO粗品 1.5
【解析】(1)本题考查铅蓄电池正负极的判断,铅蓄电池的电池反应是Pb+PbO2+2H2SO4=2PbSO4+2H2O,PbO2中Pb的化合价降低,即PbO2作正极;(2)本题考查离子反应方程式的书写、影响化学反应速率的因素,①根据图1,PbSO4溶解度大于PbCO3,说明PbCO3比PbSO4更难溶,因此离子反应方程式为PbSO4(s)+CO32-(aq)=PbCO3(s)+SO42-(aq);②随着反应的进行,碳酸钠的量减少,反应速率降低;(3)本题考查实验设计、电子式的书写,①做对照实验,取少量PbO2与试管中,向其中滴加H2O2溶液,产生可使带火星木条复燃的气体,同时棕黑色固体变为橙黄色,证实推测正确;②H2O2的结构式为H-O-O-H,其电子式为:![]() ;(4)本题考查电极反应式的书写,①根据电解原理,在阴极上得到电子,化合价降低,根据图3,阴极反应式为PbCl42-+2e-=Pb+4Cl-;②PbCl42-是PbO粗品溶解在HCl和NaCl的混合溶液中得到的,因此为了恢复其浓度,阴极区继续添加PbO粗品;(5)本题考查电化学计算,电解饱和食盐水,阳极反应式为2Cl--2e-=Cl2↑,铅蓄电池的正极反应式为PbO2+4H++SO42-+2e-=PbSO4+2H2O,产生26.88L的氯气,整个电路转移电子物质的量为26.88×2/22.4mol=2.4mol,则铅蓄电池中消耗硫酸的物质的量为2.4×2/2mol=2.4mol,开始硫酸总物质的量为0.8×4.5mol=3.6mol,反应后剩余硫酸的物质的量为(3.6-2.4)mol=1.2mol,即硫酸的浓度为c(H2SO4)=1.2/0.8mol·L-1=1.5mol·L-1。
;(4)本题考查电极反应式的书写,①根据电解原理,在阴极上得到电子,化合价降低,根据图3,阴极反应式为PbCl42-+2e-=Pb+4Cl-;②PbCl42-是PbO粗品溶解在HCl和NaCl的混合溶液中得到的,因此为了恢复其浓度,阴极区继续添加PbO粗品;(5)本题考查电化学计算,电解饱和食盐水,阳极反应式为2Cl--2e-=Cl2↑,铅蓄电池的正极反应式为PbO2+4H++SO42-+2e-=PbSO4+2H2O,产生26.88L的氯气,整个电路转移电子物质的量为26.88×2/22.4mol=2.4mol,则铅蓄电池中消耗硫酸的物质的量为2.4×2/2mol=2.4mol,开始硫酸总物质的量为0.8×4.5mol=3.6mol,反应后剩余硫酸的物质的量为(3.6-2.4)mol=1.2mol,即硫酸的浓度为c(H2SO4)=1.2/0.8mol·L-1=1.5mol·L-1。


 浙江名校名师金卷系列答案
浙江名校名师金卷系列答案 全优冲刺100分系列答案
全优冲刺100分系列答案科目:高中化学 来源: 题型:
【题目】常温下,向20ml某浓度的硫酸溶液中滴入0.1mol.l-1氨水,溶液中水电离的氢离子浓度随加入氨水的体积变化如图。下列分析正确的是

A.V=40
B.C点所示溶液中:c(H+)-c(OH-)=2c(NH3.H2O)
C.d点所示溶液中:c(NH4+)=2c(SO42-)
D.NH3.H2O的电离常数K=10-4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素X的各级电离能数据如下:
I1 | I2 | I3 | I4 | I5 | I6 | |
I/(kJ·mol1) | 568 | 1517 | 9745 | 10978 | 13931 | 17978 |
则元素A常见价态是
A.+1B.+2C.+3D.+4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】σ键可由两个原子的s轨道、一个原子的s轨道和另一个原子的p轨道以及一个原子的p轨道和另一个原子的p轨道以“头碰头”方式重叠构建而成。则下列分子中的σ键是由两个原子的s、p轨道以“头碰头”方式重叠构建而成的是( )
A.NH3B.Cl2C.H2D.O2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列溶液中溶质的物质的量浓度为1mol/L的是()
A. 含K+为2mol的K2SO4溶液
B. 将58.5NaCl溶解于1L水中
C. 将0.5mol·L-1的NaNO3溶液100mL加热蒸发掉50克水的溶液
D. 将80gSO3溶于水并配成1L溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有一包白色粉末A,由CuSO4、CaCO3、BaCl2、Na2SO4、 NaOH中的两种或两种以上的物质混合而成,为探究其组成,进行如下实验(实验流程如图):

(1)取白色粉末A,向其中加入足量水,充分搅拌后过滤,得到白色沉淀B和无色滤液C,由此可判断,原白色粉末中一定不含有_____________。
(2)向白色沉淀B中加入一定量稀盐酸,沉淀全部溶解,并产生无色气体,由此可判断,原白色粉末中一定含有_________。
(3)向无色滤液C中通入一定量二氧化碳,充分反应后过滤,得到白色沉淀D和无色滤液E,由此判断,原白色粉末中一定还含有________。
(4)若流程图中无色滤液E中只含一种溶质,则无色滤液E中的溶质为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)相同物质的量的O2和O3的质量比为___________。
(2)2.5 mol Ba(OH)2中含有__________个OH-,2.5 mol Ba(OH)2的质量是___________g。
(3)在标准状况下,1.7 g氨气所占的体积约为___________L,它与标准状况_________L硫化氢含有相同数目的氢原子。
(4)某气态氧化物化学式为RO2,在标准状况下,1.28 g该氧化物的体积为448 mL,则该氧化物的摩尔质量为_____________。
(5)同温同压下,SO2与氦气的密度之比为___________,若质量相同,两种气体的体积比为___________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com