
【题目】下列氧化物与盐酸或氢氧化钠溶液都不反应的是( )
A.COB.CO2C.CaOD.SO2
 华东师大版一课一练系列答案
华东师大版一课一练系列答案科目:高中化学 来源: 题型:
【题目】阿伏加德罗常数的值为NA。下列说法不正确的是
A. 15.6gNa2O2与过量CO2反应时,转移的电子数为0.2NA
B. 常温下,5.6g铁粉加入足量浓硝酸中反应,转移的电子数为0.3 NA
C. 常温下,4gCH4含有NA个C-H共价键
D. 分子总数为NA的ClO2和CO2混合气体中含有的氧原子数为2 NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】草酸钴(CoOC2O3)用途广泛,一种利用水钴矿[主要成分为Co2O3,还含少量Fe2O3、Al2O3、MgO、MnO、CaO等]制取CoC2O4·2H2O的工艺流程如下:

已知:①浸出液含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Al3+等;
②部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 | Mn(OH)2 |
完全沉淀的pH | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 |
(1)浸出过程中加入Na2SO3的作用是将__________还原(填离子符号),该步反应的离子方程式为_________。
(2)NaClO3的作用是将浸出液中的Fe2+氧化成Fe3+ ,氯元素被还原为最低价。该反应的离子方程式为_______________。
(3)加Na2CO3能使浸出液中Fe3+、Al3+转化成氢氧化物沉淀的原因是(用离子方程式表示,写出其中一个即可)_____________。
(4)萃取剂对金属离子的萃取率与pH的关系如右图所示。使用萃取剂适宜的pH=________(填序号)左右。

A.2.0 B.3.0 C.4.0
(5)滤液I“除钙,镁”是将溶液中Ca2+与Mg2+转化为MgF2、CaF2沉淀。已知Ksp(MgF2)=7.35×10-11、Ksp(CaF2)=1.05×10-10,当加入过量NaF后,所得滤液c(Mg2+)/c(Ca2+)=_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海洋资源丰富,海水水资源的利用和海水化学资源(主要为NaCl 和MgSO4 及K、Br 等元素)的利用具有非常广阔的前景。
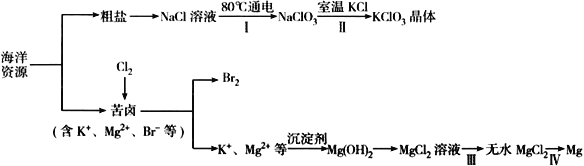
回答下列问题:
(1)NaCl 溶液由粗盐水精制而成,为除去Mg2+和Ca2+,要加入的试剂分别为__________________、__________________。
(2)写出步骤Ⅰ 中反应的总化学方程式为___________________________________。
(3)简述步骤Ⅱ中能析出KClO3 晶体而无其他晶体析出的原因是_____________________________。
(4)已知MgCl2 溶液受热时易水解生成Mg(OH)Cl,写出该过程的化学方程式__________________。
(5)为得到无水MgCl2,步骤Ⅲ的操作应为_____________________________。
(6)步骤Ⅳ中,电解熔融MgCl2 得到的镁需要在保护气中冷却,下列气体可以作为保护气的是_________
A.H2 B.N2 C. CO2 D.空气
(7)海水中溴含量为65mg·L-1。若1L 海水中95%溴元素被氧化为Br2 经热空气吹出,溴单质残留量3%。最后用SO2 将90%Br2 还原成Br-,所得溶液体积为50mL。此过程的目的为________________。所得溶液中溴离子浓度为海水中溴离子浓度的_____________倍(精确到0.1)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为验证氧化性:Cl2>Fe3+>SO2,某小组用下图所示装置进行实验(夹持仪器和A中的加热装置已略,气密性已经检验完毕)实验过程如图:
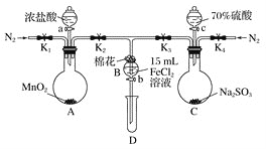
Ⅰ.打开弹簧夹K1~K4,通入一段时间N2,再将T形导管插入B中,继续通入N2,然后关闭K1、K3、K4。
Ⅱ.打开活塞a,滴加一定量的浓盐酸,给A加热。
Ⅲ.当B中溶液变黄时,停止加热,夹紧弹簧夹K2。
Ⅳ.打开活塞b,使约2 mL的溶液流入D试管中,检验其中的阳离子。
Ⅴ.打开弹簧夹K3、活塞c,加入70%的硫酸,一段时间后夹紧弹簧夹K3。
Ⅵ.更新试管D,重复过程Ⅳ,检验B溶液中的离子。
(1)过程Ⅰ的目的是________________________。
(2)棉花中浸润的溶液为__________________。作用是_______________________。
(3)A中发生反应的化学方程式:______________________________________。
(4)导致步骤Ⅲ中溶液变黄的离子反应是______________________________。用______________(写试剂化学式)检验氧化产物,现象是___________________________。
(5)能说明氧化性Fe3+>SO2的离子方程式是__________________________。
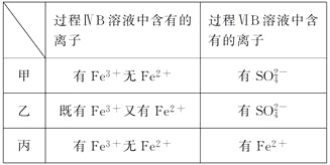
(6)甲、乙、丙三位同学分别完成了上述实验,他们的检测结果一定能够证明氧化性Cl2>Fe3+>SO2的是________________(填“甲”“乙”或“丙”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】浑浊的泥水是复杂的分散系,过滤后可以得到胶体。下列描述错误的是( )
A.浊液是一种不稳定的分散系
B.可以用“丁达尔”效应区别胶体和溶液
C.过滤得到的胶体可能带负电荷
D.河流在入海口形成“三角洲”,因为发生了胶体的凝聚
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海洋中储有大量的化学物质,储量可观的化学元素就有80多种,其中70多种可以被人类提取利用,全世界每年都要从海洋中提取大量的食盐、铁、溴、碘、钾等有用物质,海水被誉为“液体工业原料”。
从海水中提取食盐、镁和溴的流程如图所示。回答下列问题:

(1)从海水中得到的粗盐中含Mg2+、CO32-、SO42- 等杂质离子,如用试剂BaCl2、NaOH、盐酸和Na2CO3溶液,除去杂质离子,则加入试剂的顺序是___________。
(2)氨碱工业的主要反应是电解饱和氯化钠溶液,写出反应的离子方程式___________。
(3)MgCl2·6H2O脱水过程中易水解生成碱式氯化镁,化学方程式为________。因此工业上常使MgCl2·6H2O晶体在____气体中脱水而得到干燥无水的MgCl2。
(4)第⑤步是用热空气将Br2吹入SO2 溶液中,写出反应的化学方程式________。
(5)电解无水MgCl2 可得金属镁和氯气,利用副产品氯气还可制备漂白粉,其反应的化学方程式为_______。
(6)步骤④中用硫酸酸化可提高Cl2 的利用率,理由是_______________________。含高浓度Br2 的水溶液经过蒸馏可得到Br2,蒸馏的温度为80~90℃,温度过高或过低都不利于生产,请解释原因:____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究小组在实验室中将某工厂废弃的一块合金,经过一系列的反应,制得氧化铝固体、硝酸铜晶体和铁红。其实验方案如下图。

(1)该小组所用的合金中含有的金属为铁、______、______(填名称)。
(2) 操作①、③使用的主要玻璃仪器是___________,操作②的方法:________。操作④实验操作步骤包括:______、_______(填操作名称)、过滤、洗涤、干燥。
(3)写出滤渣B中较活泼金属与足量稀硝酸发生反应的离子方程式:_______。
(4)若该小组通过上述实验流程制得铁红16g,假设实验过程中无质量损失,则合金中铁的质量为________g。
(5)上述实验流程中符合“绿色化学“理念的做法是___________(答出一点即可)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com